Одно из самых удивительных свойств растворов можно наблюдать зимой на улице: когда слежавшийся снег и лёд посыпают солью, они начинают таять даже в сильный мороз! Происходит это потому, что раствор соли в воде замерзает при более низкой температуре, чем чистая вода. Обычная поваренная соль способна «растопить» лёд при температуре -21,2 °С, а хлорид кальция — при -55 °С
В 1788 г. английский физикохимик и военный врач Чарлз Благден (1748—1820) опубликовал «Опыты над способностью некоторых веществ понижать температуру замерзания воды». Учёный установил, что понижение температуры замерзания DТз раствора не зависит от химической природы растворённого вещества, а зависит только от его концентрации: DTз=Кс, где К — константа замерзания, характерная для данного растворителя, с — концентрация, выраженная в молях растворённого вещества в 1000 г растворителя. Это соотношение выполняется не только для воды, но и для других растворителей, когда концентрация раствора не очень велика. Константа К показывает, на сколько градусов понизится температура замерзания, если в 1000 г растворителя внести 1 моль какого-либо вещества. Для воды эта константа равна 1,85 °С, для бензола — 5,1 °С, для циклогексана — 20 °С, для камфоры (в расплавленном состоянии) — 40 °С. Проведя точные исследования с различными растворителями, французский физик и химик Франсуа Мари Рауль (1830—1901) в 1885 г. предложил использовать значения DТз для определения молекулярной массы различных веществ. Этот метод он назвал криоскопией (от греч. «криос» — «холод» и «скопео» — «смотрю», «наблюдаю»).
Метод криоскопии очень помог учёным в распознавании структуры новых соединений. Определив молекулярную массу путём криоскопии, химики могли с большей уверенностью судить о строении вещества. Недаром в лаборатории шведского физикохимика Сванте Августа Аррениуса
(1859—1927), в которой проводили тысячи криоскопических определений, бытовала шутка: «В Европе снова наступил ледниковый период...».
Понижение температуры плавления при образовании растворов находит разнообразное практическое применение. Для охлаждения в зимних условиях двигателей внутреннего сгорания вместо воды используются антифризы (от греч. «анти-» — «противо-» и англ. freeze — «замерзать»). Наиболее распространены антифризы на основе смесей воды и этилен-гликоля ОН—СН2—СН2—ОН (он замерзает при -13,2 °С). С повышением концентрации этиленгликоля температура замерзания раствора постепенно понижается, достигая -49,3 °С при 60 % этиленгликоля (по массе).
Как известно, растворы не только замерзают при более низкой температуре, чем чистый растворитель, но и кипят при более высокой. Формула, описывающая повышение температуры кипения DTк, точно такая же, только смысл констант другой: DTк=Еc, где величина Е показывает, на сколько градусов повысится температура кипения раствора, если в 1000 г растворителя внести 1 моль вещества. Подобные измерения тоже позволяют определять молекулярные массы различных веществ. Этот метод называется эбулиоскопией (от лат. ebullire — «выкипать»). Он менее точен по сравнению с криоскопией, потому что эбулиоскопические константы Е, как правило, бывают меньше криоскопических К. Так, для воды E=0,51 °С, для бензола — 2,5 °С, для циклогексана — 2,8 °С
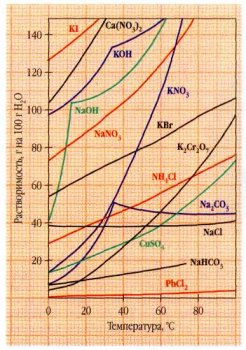
Растворимость солей и щелочей в воде в зависимости от температуры.
Растворённые в океанской воде соли понижают температуру плавления льда.
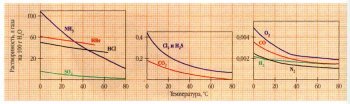
Растворимость газов в воде при атмосферном давлении в зависимости от температуры.

Похожие статьи