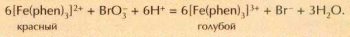С декабря 1997 г. самый известный журнал, посвящённый химическому образованию, «Journal of Chemical Education», перестал публиковать статьи о способах подбора коэффициентов в реакциях. Его главный редактор Джон Мур, университетский профессор химии в городе Мэдисон (штат Висконсин), объяснил столь строгое решение тем, что самому ему приходилось подбирать «трудные» коэффициенты только по заданию преподавателей, когда он был первокурсником, тогда как для его многолетней профессиональной деятельности как химика-исследователя это практически никогда не требовалось. Более того, редактор уверен, что в трудных случаях подбор коэффициентов лучше поручить компьютеру: самая простенькая программа сделает всё, что надо, лучше химика и за доли секунды. И вот здесь уважаемый профессор ошибся!
Оказывается, компьютерные программы заботятся лишь о том, чтобы сохранялся материальный баланс по каждому из элементов, и совершенно равнодушны к тому, имеют ли найденные коэффициенты какой-либо химический смысл. В качестве типичного примера можно привести следующее уравнение реакции, опубликованное в упомянутом американском журнале: 88Н2+12BrCl+6РbСrO4+6Na[AlF4+6KI+3MgSiO3+2H3PO4+10FeSO4+20SO2+15Ca(CN)2+3CF2Cl2=15CaF2+6K[Al(OH)4]+3MgCO3+3Na2SiO3+2PI3+10Fe(SCN)3+6PbBr2+6CrCl3+70H2O.
Направление многих окислительно-восстановительных реакций зависит от кислотности среды. Примером может служить взаимодействие бромат-ионов BrO-3 с ферроином — комплексом железа(II) с органическим соединением 1,10-фенантролином (phen). В сильнокислой среде бромат-ион окисляет ферроин, и свойственная его растворам красная окраска сменяется голубой, характерной для комплекса железа(III). При подщелачивании голубого раствора железа(III) оно восстанавливается бромид-ионами в железо(Н), и красная окраска ферроина возвращается:
Точно предсказать продукты неисследованной реакции во многих случаях не в состоянии ни один химик. Их определяют экспериментально.
А затем уже предлагают возможный механизм реакции и объясняют, почему образуются именно эти продукты.
Отличие современной химии от средневековой состоит в том, что появились надёжные теории, которые позволяют с большой долей вероятности предсказывать продукты новых реакций и вести целенаправленный синтез веществ. Разработаны они и для процессов окисления-восстановления. Сами по себе эти теории довольно сложные, но существует несколько простых рецептов, пользуясь которыми, даже начинающий химик сможет предвидеть результаты многих окислительно-восстановительных реакций.
Для этого нужно знать важнейшие окислители и восстановители, представлять их относительную окислительную и восстановительную способность, помнить наиболее распространённые степени окисления элементов в соединениях и понимать, в виде каких ионов или молекул эти вещества существуют в той или иной среде.
Самый распространённый на Земле окислитель — кислород. Намного более сильным окислителем является озон О3 — аллотропная модификация кислорода. Он способен окислять многие вещества, которые с кислородом при обычных условиях не реагируют, например оксид азота(1\/): 2NO2+О3= N2O5+O2 и серебро: 2Ag+2О3=Ag2O2+2О2.
Наиболее сильный окислитель из числа простых веществ — фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и характера среды. Кроме него применяют также дихромат калия К2Сг2О7, азотную кислоту HNO3, пероксид водорода Н2О2, хлор С12, гипохлорит натрия NaClO. Очень сильные окислители — фториды благородных газов. Самый сильный из известных окислителей — фторид кислорода OF2.
Из восстановителей наиболее распространённый в природе — углерод. Его широко используют в промышленности для получения металлов из оксидов: Fe2O3+3С=2Fe+3СО; ZnO+С=Zn+CO.
Первую химическую реакцию человек провёл тогда, когда научился добывать огонь. С той поры и до настоящего времени реакции горения играют первостепенную роль в нашей жизни. Они приносят в дома тепло, двигают автомобили, самолёты и ракеты, помогают извлекать ценные вещества из природного сырья.
Флогистонная теория Шталя впервые выделила процессы горения и прокаливания металлов в отдельную группу реакций (см. статью «Химия в XVIII веке»). Кислородная теория горения, предложенная Лавуазье, обобщила экспериментальный материал, накопленный в «эпоху флогистона». А кроме того, Лавуазье выдвинул кислородную теорию кислот: он полагал, что своими свойствами кислоты обязаны присутствию в них кислорода (отсюда и название элемента oxygenium — «рождающий кислоты»). Поэтому реакции горения веществ на воздухе стали называть окислением, а
процессы, обратные окислению, т. е. связанные с уменьшением количества кислорода в веществе, — раскислением или восстановлением. Поскольку в ходе окислительных реакций вещество нередко разрушается (как, например, при ржавлении), термин «восстановление» указывает на процесс, противоположный окислению.
В дальнейшем представления о сущности процесса окисления значительно расширились. Как показали эксперименты, многие вещества (водород, металлы) горят не только в кислороде, но и в хлоре, броме. А значит, окисление — это не только присоединение кислорода. В 1914 г. русский учёный Лев Владимирович Писаржевский (1874—1938) предложил электронно-ионную теорию окислительно-восстановительных реакций.
В наши дни химикам известны тысячи самых разных окислительно-восстановительных реакций, в том числе и протекающих в живых организмах. Можно с уверенностью говорить: химия жизни — это процессы окисления-восстановления.
Обычно считается, что измельчение вещества — физический процесс. Однако это не совсем так. При длительной обработке в специальных мельницах частицы вещества за счёт поглощения энергии переходят в химически активное состояние: усиливаются колебательные движения атомов, молекул и ионов в узлах кристаллической решётки, ослабляются связи между ними, рвутся некоторые связи, возникают свободные радикалы.
Простейшие химические реакции обычно подразделяют на четыре типа: реакции соединения, разложения, замещения и обмена. Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно, или, вообще, из данного числа — меньшее их число». Например, при нагревании порошков железа и серы образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе: С+О2=СО2. Они всегда сопровождаются выделением тепла — являются экзотермическими (см. статью «Тепло химических реакций»).
Реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Так, при накаливании дерева (без доступа воздуха. — Прим. ред.) получается горючий газ, водянистая жидкость, смола или дёготь и уголь». Более простой пример — разложение известняка: СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов (Менделеев называл их реакциями перемещения). Если взаимодействуют простое вещество и сложное — это реакция замещения: Fe+CuSO4= FeSO4+Cu.
О том, что мы имеем дело с химической реакцией, а не с физическим процессом, обычно можно судить по нескольким внешним признакам: выделению или поглощению тепла, образованию осадка, выделению газа, изменению окраски, вкуса и запаха веществ (разумеется, при подобном анализе нужна известная осторожность). Правда, иногда этого бывает недостаточно. Есть химические превращения, при которых теплота не поглощается и не выделяется или же тепловой эффект столь незначителен, что его сложно зафиксировать. Более того, ряд перечисленных признаков может соответствовать и физическим процессам. Стоит открыть, например, бутылку с газированным напитком, как из неё с шипением вырвется углекислый газ, который был растворён в воде под большим давлением. А при охлаждении насыщенного раствора растворённое вещество часто выпадает в осадок.
ФИЗИЧЕСКИЙ ПРОЦЕСС И ХИМИЧЕСКАЯ РЕАКЦИЯ
Если бы миллионы разнообразных веществ, а следовательно, и тела, из них состоящие, не претерпевали никаких изменений, мир был бы скучным и застывшим, лишённым движения, развития. К счастью, мир устроен иначе. Под воздействием внешних условий (температуры, давления, освещённости и др.) вещества изменяются. Вода закипает и переходит в пар, лёд тает, распускаются и опадают листья, расцветают и увядают цветы. Течёт жизнь...
Изменения веществ и тел обычно подразделяют на два типа: физические процессы и химические превращения (реакции).
Физический процесс не затрагивает молекул (или других мельчайших структурных единиц) веществ. Их химический состав остаётся прежним, меняется лишь форма тела (при деформации), размер частичек (при измельчении вещества), агрегатное состояние. Кипение воды, вытягивание алюминиевой проволоки, появление инея, выпадение росы, образование тумана, измельчение мрамора — всё это физические процессы. При этом молекулы воды не распадаются на атомы, атомы алюминия не объединяются в молекулы.
А вот явления, в ходе которых одни вещества превращаются в другие, называют химическими превращениями или химическими реакциями. Они тоже знакомы каждому: горение древесины, ржавление железа, прогоркание масла, скисание молока... Химическая реакция — это взаимодействие частиц (молекул, атомов) вещества или разных веществ друг с другом, которое приводит к разрыву старых и образованию новых химических связей. При этом изменяется строение молекул исходных веществ и, как правило, состав (есть и такие химические реакции, при которых состав вещества не меняется, например превращение графита в алмаз).
Тот, кто побывал в музее минералогии или на выставке минералов, не мог не восхититься изяществом и красотой форм, которые создала «неживая» природа. А кто из нас не любовался снежинками: их разнообразие поистине бесконечно! Ещё в XVII в. знаменитый немецкий астроном Иоганн Кеплер написал трактат «О шестиугольных снежинках», а в XX столетии были изданы альбомы, где представлены тысячи увеличенных фотографий "снежинок, причём ни одна из них не повторяет другую.
Особое место среди кристаллов занимают драгоценные камни, которые с древнейших времён привлекают внимание человека. Невозможно оторвать взгляд от сверкающих всеми цветами радуги алмазов, рубинов, изумрудов, сапфиров, аметистов... Теперь многие драгоценные камни люди научились получать искусственно. Например, подшипники для часов и других точных приборов уже давно делают из искусственных рубинов. А можно создать и такие кристаллы, которых в природе вообще не существует.
Многие видные химики, минералоги и другие учёные начинали свои первые школьные опыты именно с выращивания кристаллов. Опыты эти относительно просты, но их результаты порой могут вызвать удивление и восхищение.
Чтобы вырастить кристалл, полезно знать, какие процессы управляют его ростом; почему разные вещества дают кристаллы различной формы, а некоторые вовсе не образуют кристаллов; что надо сделать, чтобы кристаллы получились большими и красивыми.
Классические теории трактуют химическую связь как взаимодействие двух атомов. Однако открыто уже довольно много необычных молекул, в которых химическая связь возникает сразу между несколькими атомами. Такие связи называют многоцентровыми.
Простейший пример молекулы с трёхцентровой связью — ион метония СН+5. В нём три из пяти атомов водорода связаны с центральным атомом углерода обычной ковалентной связью. Два других атома водорода удалены от атома углерода на большее расстояние. Трёхцентровую связь между этими атомами осуществляют всего два электрона: один из них предоставлен углеродом, а другой — водородом.
Трёхцентровую связь иногда обозначают треугольником, в вершинах которого находятся связанные атомы.
В молекуле ферроцена, или дициклопентадиенилжелеза Fe(C5H5)2, атом Fe, расположенный между двумя циклопентадиенильными кольцами, одновременно связан со всеми десятью атомами углерода обоих колец. Связь между этими 11 атомами осуществляют 12 p-электронов двух ароматических колец.
Чтобы можно было сравнивать друг с другом химические связи, в том числе и связи разных типов, используют единые количественные характеристики, среди которых главные — длина, энергия, полярность и порядок связи.
Дипольные взаимодействия в молекулярном кристалле.