Обычно считается, что измельчение вещества — физический процесс. Однако это не совсем так. При длительной обработке в специальных мельницах частицы вещества за счёт поглощения энергии переходят в химически активное состояние: усиливаются колебательные движения атомов, молекул и ионов в узлах кристаллической решётки, ослабляются связи между ними, рвутся некоторые связи, возникают свободные радикалы.
Простейшие химические реакции обычно подразделяют на четыре типа: реакции соединения, разложения, замещения и обмена. Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно, или, вообще, из данного числа — меньшее их число». Например, при нагревании порошков железа и серы образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе: С+О2=СО2. Они всегда сопровождаются выделением тепла — являются экзотермическими (см. статью «Тепло химических реакций»).
Реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Так, при накаливании дерева (без доступа воздуха. — Прим. ред.) получается горючий газ, водянистая жидкость, смола или дёготь и уголь». Более простой пример — разложение известняка: СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов (Менделеев называл их реакциями перемещения). Если взаимодействуют простое вещество и сложное — это реакция замещения: Fe+CuSO4= FeSO4+Cu.
О том, что мы имеем дело с химической реакцией, а не с физическим процессом, обычно можно судить по нескольким внешним признакам: выделению или поглощению тепла, образованию осадка, выделению газа, изменению окраски, вкуса и запаха веществ (разумеется, при подобном анализе нужна известная осторожность). Правда, иногда этого бывает недостаточно. Есть химические превращения, при которых теплота не поглощается и не выделяется или же тепловой эффект столь незначителен, что его сложно зафиксировать. Более того, ряд перечисленных признаков может соответствовать и физическим процессам. Стоит открыть, например, бутылку с газированным напитком, как из неё с шипением вырвется углекислый газ, который был растворён в воде под большим давлением. А при охлаждении насыщенного раствора растворённое вещество часто выпадает в осадок.
ФИЗИЧЕСКИЙ ПРОЦЕСС И ХИМИЧЕСКАЯ РЕАКЦИЯ
Если бы миллионы разнообразных веществ, а следовательно, и тела, из них состоящие, не претерпевали никаких изменений, мир был бы скучным и застывшим, лишённым движения, развития. К счастью, мир устроен иначе. Под воздействием внешних условий (температуры, давления, освещённости и др.) вещества изменяются. Вода закипает и переходит в пар, лёд тает, распускаются и опадают листья, расцветают и увядают цветы. Течёт жизнь...
Изменения веществ и тел обычно подразделяют на два типа: физические процессы и химические превращения (реакции).
Физический процесс не затрагивает молекул (или других мельчайших структурных единиц) веществ. Их химический состав остаётся прежним, меняется лишь форма тела (при деформации), размер частичек (при измельчении вещества), агрегатное состояние. Кипение воды, вытягивание алюминиевой проволоки, появление инея, выпадение росы, образование тумана, измельчение мрамора — всё это физические процессы. При этом молекулы воды не распадаются на атомы, атомы алюминия не объединяются в молекулы.
А вот явления, в ходе которых одни вещества превращаются в другие, называют химическими превращениями или химическими реакциями. Они тоже знакомы каждому: горение древесины, ржавление железа, прогоркание масла, скисание молока... Химическая реакция — это взаимодействие частиц (молекул, атомов) вещества или разных веществ друг с другом, которое приводит к разрыву старых и образованию новых химических связей. При этом изменяется строение молекул исходных веществ и, как правило, состав (есть и такие химические реакции, при которых состав вещества не меняется, например превращение графита в алмаз).
Тот, кто побывал в музее минералогии или на выставке минералов, не мог не восхититься изяществом и красотой форм, которые создала «неживая» природа. А кто из нас не любовался снежинками: их разнообразие поистине бесконечно! Ещё в XVII в. знаменитый немецкий астроном Иоганн Кеплер написал трактат «О шестиугольных снежинках», а в XX столетии были изданы альбомы, где представлены тысячи увеличенных фотографий "снежинок, причём ни одна из них не повторяет другую.
Особое место среди кристаллов занимают драгоценные камни, которые с древнейших времён привлекают внимание человека. Невозможно оторвать взгляд от сверкающих всеми цветами радуги алмазов, рубинов, изумрудов, сапфиров, аметистов... Теперь многие драгоценные камни люди научились получать искусственно. Например, подшипники для часов и других точных приборов уже давно делают из искусственных рубинов. А можно создать и такие кристаллы, которых в природе вообще не существует.
Многие видные химики, минералоги и другие учёные начинали свои первые школьные опыты именно с выращивания кристаллов. Опыты эти относительно просты, но их результаты порой могут вызвать удивление и восхищение.
Чтобы вырастить кристалл, полезно знать, какие процессы управляют его ростом; почему разные вещества дают кристаллы различной формы, а некоторые вовсе не образуют кристаллов; что надо сделать, чтобы кристаллы получились большими и красивыми.
Классические теории трактуют химическую связь как взаимодействие двух атомов. Однако открыто уже довольно много необычных молекул, в которых химическая связь возникает сразу между несколькими атомами. Такие связи называют многоцентровыми.
Простейший пример молекулы с трёхцентровой связью — ион метония СН+5. В нём три из пяти атомов водорода связаны с центральным атомом углерода обычной ковалентной связью. Два других атома водорода удалены от атома углерода на большее расстояние. Трёхцентровую связь между этими атомами осуществляют всего два электрона: один из них предоставлен углеродом, а другой — водородом.
Трёхцентровую связь иногда обозначают треугольником, в вершинах которого находятся связанные атомы.
В молекуле ферроцена, или дициклопентадиенилжелеза Fe(C5H5)2, атом Fe, расположенный между двумя циклопентадиенильными кольцами, одновременно связан со всеми десятью атомами углерода обоих колец. Связь между этими 11 атомами осуществляют 12 p-электронов двух ароматических колец.
Чтобы можно было сравнивать друг с другом химические связи, в том числе и связи разных типов, используют единые количественные характеристики, среди которых главные — длина, энергия, полярность и порядок связи.
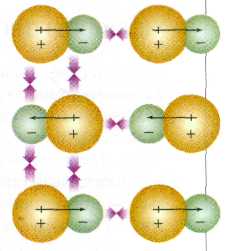
Дипольные взаимодействия в молекулярном кристалле.
Основных типов химических связей три — ковалентная, ионная и металлическая. Но иногда важную роль могут играть довольно слабые силы, действующие между молекулами. Этими силами в основном определяются температуры плавления и кипения веществ, а также некоторые их химические свойства.
Все молекулы электрически нейтральны. Однако во многих из них центры отрицательных и положительных зарядов находятся в разных местах. В таких случаях молекулу называют диполем. Полярные молекулы легко притягиваются друг к другу.
Правда, взаимодействие диполей относительно слабое: его энергия обратно пропорциональна шестой степени расстояния между центрами молекул Е~ 1/r6 (для сравнения: энергия кулоновского взаимодействия Е~1/r). Поэтому оно проявляется главным образом в твёрдом и жидком состояниях, когда расстояния между молекулами намного меньше, чем в газе. В твёрдом состоянии молекулярные диполи ориентированы так, что положительные полюса одних максимально приближены к отрицательным полюсам других.
Аля металлов характерен особый тип химической связи: валентные электроны всех атомов объединяются в так называемый электронный газ и свободно двигаются в кристаллической решётке, образованной ионами. Каждый электрон как бы принадлежит всем атомам одновременно, и кристалл металла можно рассматривать как одну гигантскую молекулу. В таких молекулах МО имеют особые свойства.
Рассмотрим кусок лития массой 1,17 г. Он содержит 1/6 моль лития, т. е. 1023 атомов, каждый из которых имеет наполовину заполненную валентную 2s-орбиталь. Все 1023 атомных орбиталей в молекуле превращаются в 1023 молекулярных орбиталей, энергия которых изменяется в пределах 100 кДж/моль, а сами орбитали распределены (делокализованы) по всей молекуле. Хорошая электрическая проводимость металлов объясняется тем, что разница в энергии между двумя соседними МО составляет ничтожно малую величину: 100/1023=10-21 кДж/моль. Поэтому электроны могут свободно переходить с орбитали на орбиталь при наличии внешнего электрического поля.
Понятие валентности в химии долго считалось одним из основных. «Валентность — фундаментальное свойство атома, — писал более века назад знаменитый немецкий учёный, один из создателей теории химического строения Фридрих Кекуле, — свойство такое же постоянное и неизменяемое, как и самый атомный вес». Однако в современной научной литературе этот термин употребляется не очень широко. Более того, даже в учебниках он трактуется по-разному.
Так, если валентность определять общим числом электронов, участвующих в образовании химических связей с другими атомами, то азот в HNO3 следует считать пятивалентным, поскольку его атом использовал все свои пять внешних электронов — два s-электрона (спаренные) и три р-электрона (неспаренные):
Если же валентность определять числом электронных пар, которыми данный атом связан с другими, то максимальная валентность азота будет равна четырём.
При этом три р-электрона образуют с электронами других атомов три ковалентные связи, а ещё одна образуется за счёт двух s-электронов. Пример — реакция аммиака с кислотами.
Наконец, если определять валентность только числом неспаренных электронов в атоме, то валентность азота не может превышать трёх, поскольку распаривание s-электронов невозможно — для этого у атома азота нет подходящих орбиталей. Например, в галогенидах азот образует только три ковалентные связи, и не существует таких соединений, как NCl5, или NBr5 (в отличие от вполне стабильных РСl5 и РВr5).
Электронная плотность создаётся всеми электронами в молекуле. Одни из них при образовании молекулы из атомов остаются практически неизменными, другие меняются очень сильно. Для понимания природы химической связи наиболее интересно поведение последних.
Для описания электронов в атоме используют понятие атомной орбитали (АО), которая характеризует вероятность нахождения электрона в каждой точке пространства (вне орбитали электронная плотность мала). То же справедливо и для молекул. Состояние каждого электрона в молекуле характеризуется понятием молекулярной орбитали (МО). Если известна форма МО, можно определить те места в молекуле, где электрон, находящийся на этой орбитали, бывает чаще всего.
Очень наглядное представление о химической связи даёт квантовая механика. Эта наука позволяет с высокой точностью рассчитать распределение электронов в молекуле. Функцию, которая описывает вероятность нахождения электронов в любой точке молекулы, называют электронной плотностью. Её измеряют в долях единицы, а для её изображения обычно используют поверхности равной плотности, т. е. выбирают какое-либо значение, например 0,002 или 0,08, и показывают все точки в пространстве, в которых электронная плотность принимает это значение (трёхмерное изображение). Есть и другой способ — выбрать какую-либо плоскость (сечение) и рассматривать значения электронной плотности только в этой плоскости (контурная карта).
Чем же хороша электронная плотность? Во-первых, она позволяет изобразить так называемое электронное облако молекулы. Поверхность с электронной плотностью 0,002 обычно сосредотачивает в себе больше 98% всей электронной плотности, поэтому она отражает размеры и форму электронного облака.
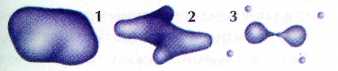
Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
