«Если металлический алюминий облить (или даже просто смочить) раствором сулемы (дихлорида ртути HgCl2. — Прим. ред.), ртуть восстановляется и даёт амальгаму, в виде которой алюминий окисляется очень легко и разлагает воду при обыкновенной температуре...
При обыкновенной температуре металлический алюминий воды не разлагает, но если к ней прибавить немного иода, или йодистого водорода и иода, или йодистого алюминия и иода, водород в обилии выделяется», — читаем в «Основах химии» Д. И. Менделеева.
Лишённый оксидной плёнки, алюминий активно взаимодействует с водой: 2Al + ЗН2О=2АКОН)3¯+3Н2, а на воздухе быстро окисляется, при этом металл нагревается и обрастает белой «бородой» оксида: 4Al + 3О2=2Al2О3. Оксид и гидроксид алюминия амфотерны, т. е. вступают в реакцию как с кислотами (с образованием солей алюминия, например AlCl3), так и с щелочами (образуя алюминаты: Na[Al(OH)4] — в растворе или NaAlO2 — при сплавлении с твёрдой щёлочью). Интересно, что выдержанный при высоких температурах Al2О3 становится инертным — утрачивает способность к взаимодействию даже с концентрированными кислотами.
Алюмотермией называют метод восстановления металлов из оксидов порошком металлического алюминия. Так можно получить корольки (маленькие слитки) многих переходных металлов, например хрома, марганца, ванадия, железа:
2Al+Fe2O3=Al2O3+Fe. Если поджечь с помощью магниевой ленты смесь, состоящую из алюминия и оксида железа, а после этого остывший тигель разбить молотком, из образовавшейся массы (пека) нетрудно извлечь королёк металла.
В 1880 г. в колледж маленького американского городка Оберлин близ Кливленда (штат Огайо) поступил Чарлз Мартин Холл (1863—1914). В том же голу профессором химии и минералогии этого колледжа стал 36-летний Фрэнк Фаннинг Джуэтт. Встреча первокурсника и преподавателя оказалась решающей в истории алюминия. Джуэтт ранее стажировался в Германии, работал у знаменитого химика-органика Фридриха Вёлера, обсуждал с ним проблемы получения алюминия. С собой в Америку Джуэтт привёз и образец редкого металла.
Холл увлёкся химией ещё в детстве. Он нашёл старый учебник химии своего отца и усердно штудировал его, ставил опыты. Однажды мать даже устроила ему нагоняй за порчу обеденной скатерти после самодельного фейерверка. А спустя десять лет Холл стал первым человеком, получившим алюминий электролизом. Впоследствии Джуэтт описал, как это произошло:
«Моим самым важным открытием было открытие человека. В 1880 году я обратил внимание на мальчика лет шестнадцати. Он регулярно заходил в химическую лабораторию, чтобы купить на несколько центов стеклянные трубки, пробирки и тому подобное. Я ничего не знал об этом мальчике, но подумал, что когда-нибудь его имя станет известным: ведь он уже проводит опыты, когда другие думают только об играх и развлечениях. Это был Чарлз М. Холл, который в возрасте 21 года открыл способ восстановления алюминия из руды и таким образом сделал алюминий тем замечательным металлом, которым теперь широко пользуются во всём мире...».
Во многих популярных книгах по химии приводится легенда о том, что некий мастер, имя которого история не сохранила, принёс римскому императору Тиберию (14—27 гг. н. э.) чашу из металла, напоминающего серебро, но более лёгкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы.
Эта легенда основана на рассказе Плиния Старшего, приведённом в «Естественной истории». Согласно Плинию, похожий на серебро металл был получен из «глинистой земли». Глинозём — это гидратированный оксид алюминия Аl2О3•nН2О, а белая глина (каолин) — алюмосиликат:
Al2O3•2SiO2•2Н2O.
Алюминий называют металлом XX века. Когда его открыли в 1825 г., он стоил в 1500 раз дороже железа (сейчас — втрое). Лаже 30 лет спустя на его слиток, демонстрировавшийся на Всемирной выставке в Париже, смотрели как на драгоценность. И это неудивительно: для восстановления алюминия из его руд необходимо затратить очень большое количество энергии.
Алюминий прочно вошёл в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока.
Изделия из алюминия.
А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 г. килограмм металла стоил 1200 долларов — дороже золота! Почему же со временем цена на алюминий так упала? Ответ прост: алюминий широко распространён в земной коре (8%), уступая в этом лишь кислороду и кремнию. «Достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в коре земной. «...Алюминий, или металл квасцов (alumen), потому и называется иначе глинием, что находится в глине», — писал Д. И. Менделеев. Белая глина, или каолин Аl2О3•2SiO2•2Н2О, рождается при выветривании алюмосиликатов, например полевого шпата ортоклаза К2О•Аl2О3•6SiO2, слюды К2О•3Аl2О3•6SiO2•2Н2О, нефелина (Na, К)2О•Аl2О3•2SiO2. Одновременно с глиной при этом образуются кварцевый песок SiO2, бокситы Аl2О3•2Н2О и корунд Аl2О3. Окрашенные кристаллы корунда — это широко известные драгоценные камни рубин и сапфир.
При сплавлении оксида алюминия с порошками основных оксидов (например, магния, кальция, кобальта) образуются вещества, которые долгое время рассматривали как соли «алюминиевой кислоты» HAlO2 или метаформы гидроксида алюминия AlOOH. Исследование структуры этих соединений показало, что многие из них представляют собой сложные оксиды, в кристаллической решётке которых катионы двух металлов находятся в пустотах между ионами кислорода. Такое строение, в частности, имеет тенарова синь, образующаяся при прокаливании оксида алюминия с оксидом кобальта (II) при 1100 °С: СоО+Al2O3=CoAl2O4. Это вещество (tпл=1960 °С) используется в качестве синей краски, например, в производстве гжельской керамики.

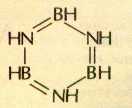
Бор образует с азотом и водородом несколько интересных соединений, которые можно рассматривать как аналоги углеводородов: боразан
ВН3—NH3 (аналог этана); боразен BH2=NH2 (аналог этилена); боразин BHºNH (аналог ацетилена).
Подобно тому как из ацетилена может быть получен бензол, из боразина образуется боразол (неорганический бензол) — бесцветная горючая жидкость (tкип=55 °С) с характерным запахом:
Борную кислоту, а иногда и её натриевую соль — буру — можно найти во многих домашних аптечках как в чистом виде, так и в составе мазей, спиртового раствора — «борного спирта», полосканий для горла и т. п. И если к буре отношение обычно несколько настороженное (всё-таки это вещество используют как яд для тараканов), то борную кислоту считают вполне безобидной. В справочниках по лекарственным средствам, выпушенных миллионными тиражами, можно прочитать, что борную кислоту «применяют... как антисептическое средство в виде водных растворов (2—4%) для полоскания полости рта, зева и для промывания глаз; назначают также в виде мази (5—10%) и в присыпках при заболеваниях кожи». Борную кислоту веками признавали абсолютно безопасным средством и без колебаний использовали как антисептик даже для новорождённых. До сих пор многие мамы и бабушки по традиции применяют раствор борной кислоты, чтобы промыть ребёнку глаза, не ведая, что... травят его ядом!
Борная кислота на самом деле яд; и хотя он слабый, но имеет весьма коварные свойства. Соединения бора действуют не на отдельные виды микроорганизмов, как антибиотики, а на все сразу, поскольку бор является так называемым общеклеточным ядом. А коварство его в том, что этот яд не имеет никаких противоядий и чрезвычайно медленно выводится из организма. Даже взрослый человек при абсолютно здоровых почках за неделю теряет примерно лишь пятую часть попавшего в организм бора. Бор поражает не только желудочно-кишечный тракт, но и кожу, почки, центральную нервную систему. Последнее сопровождается судорогами и может окончиться даже параличом. Недаром применение борной кислоты для приёма внутрь было повсеместно запрещено ещё в конце XIX в. А ведь до этого борная кислота применялась очень широко.
Нитрид бора BN по структуре подобен углероду: в обоих веществах (в равных молярных количествах) содержится одинаковое число электронов. Как и углерод, нитрид бора существует в двух формах, построенных аналогично алмазу и графиту. При взаимодействии оксида бора с аммиаком в присутствии сажи при температуре порядка 2000 °С образуется нитрид бора со структурой графита: В2О3+3С+2NH3=2BN+3СО+3Н2. При высоких давлениях он переходит в алмазоподобную модификацию — боразон.
На основе нитрида бора созданы огнеупорные материалы, в том числе термостойкое волокно. Разные модификации нитрида бора используют как смазку для подшипников и как сверхтвёрдый абразивный материал — порошкообразное вещество, служащее для механической обработки металлов, сплавов, камней и т. п.
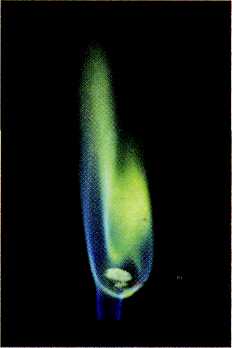
Обнаружить присутствие бора в веществе несложно: летучие соединения бора окрашивают пламя в зелёный цвет. В этом можно убедиться, внеся в пламя горелки несколько кристалликов борной кислоты.
Хотя элемент бор встречается в природе сравнительно редко (в земной коре его почти в 7 тыс. раз меньше, чем алюминия), главным образом в виде солей борной кислоты, бура — кристаллогидрат тетрабората натрия Na7B4O7•10Н2О — была известна уже в раннем Средневековье. В сочинениях арабских алхимиков говорится об использовании её в качестве плавня, а также для пайки драгоценных металлов. С Памира и с отрогов Гималаев буру доставляли караванами в Багдад.
Долгое время состав буры оставался неизвестным. Лишь в 1702 г. ученик Роберта Бойля Вильгельм Гомберг (1662—1715), прокаливая буру с железным купоросом, получил борную кислоту Н3ВО3, которую назвал успокоительной солью (sal sedativum) no будто бы производимому ею действию. Это вещество нашло широкое применение в медицине того времени. Спустя полвека было доказано, что бура является солью борной кислоты: она образуется при взаимодействии «успокоительной соли» с содой Na2CO3.
Цемент (от лат. caementum — «битый камень») — это порошкообразный материал, при смешивании с водой образующий пластичную массу (цементное тесто), которая при затвердевании превращается в камневидную структуру. Обычный, так называемый портландцемент состоит из силикатов и алюмосиликатов кальция: Ca3SiO5, Ca2SiO4, Ca3(AlO3)2 и др. Эти соединения образуются при спекании известняка с кварцевым песком и глиной во вращающихся печах при температуре порядка 1500 °С:
3СаСО3+SiO2=Ca3SiO5+3СО2
8СаСО3+Al2O3 •2SiO2•2Н2О = Са3(АlO3)2+Ca2SiO4+Ca3SiO5+2Н2О+8СО2.
Смешанный с водой цемент постепенно затвердевает (схватывается), что связано с протеканием процессов гидратации и гидролиза силикатов и алюминатов кальция:
Ca3SiO5+3Н2О=Ca2SiO4•2Н2О+Са(ОН)2
Ca2SiO4+2Н2О=Ca2SiO4•2Н2О Са3(АlO3)2+6Н2О=Са3(АlO3)2•6Н2О.
Для полного затвердевания цементного теста требуется три-четыре недели. В строительстве широко используется бетон (от лат. bitumen — «горная смола») — смесь цементного теста с песком и щебнем. Бетон закладывают в специальные деревянные формы, в которых он постепенно затвердевает. Для увеличения прочности конструкций в формы помешают арматуру — стальной каркас. Такой материал называется железобетоном. Магнезиальный цемент получают смешением оксида магния с концентрированным раствором хлорида магния. При затвердевании смеси образуется полимер состава HOMgO(—MgO—)nMgCl, из которого обычно делают подоконники, ступени лестниц.
Гидроксиды кальция, стронция и бария — щёлочи, хотя растворимость Са(ОН)2 и Sr(OH)2 при комнатной температуре низкая. У гидроксида кальция она падает с ростом температуры: наибольшей концентрации удаётся достичь, насыщая Са(ОН)2 ледяную воду (растворимость при О °С составляет 0,173 г на 100 г воды, при 20 °С — 0,166 г, а при 100 °С — 0,08 г). Насыщенный раствор Са(ОН)2 называется известковой водой.
Гидроксид бария растворяется значительно лучше (4,3 г на 100 г воды при 20 °С), причём при повышении температуры его растворимость резко возрастает (при 80 °С — 101,5 г на 100 г воды). Этим свойством пользуются для перекристаллизации вещества: медленно охлаждая насыщенный при 80 °С раствор, получают красивые пластинчатые кристаллы кристаллогидрата Ва(ОН)2•8Н2О. По аналогии с известковой водой насыщенный раствор гидроксида бария называется баритовой водой.
Кристаллогидрат Ва(ОН)2•8Н2О.

