Древние философы относили воздух к числу важнейших стихий, из которых построен мир. Леонардо да Винчи (1452—1519), изучая процессы горения, отмечал, что воздух состоит из различных «частей» (веществ), но только одна из них расходуется при горении. Подобную мысль высказывали и другие учёные XVI—XVIII вв. Однако кислород открыли лишь в 70-х гг. XVIII столетия независимо друг от друга английский химик Джозеф Пристли и его шведский коллега Карл Шееле.
Мышьяк. Его природные соединения необычайно красивы. Это сульфиды — красный реальгар As4S4 (от араб, «рахдж аль гхар» — «пыль пещеры, рудника») и золотисто-жёлтый аурипигмент As2S3, которые упоминаются уже античными авторами. Алхимики считали, что мышьяк является составной частью всех металлов. Особое отношение к мышьяку в Средние века объясняется не только тем, что многие его соединения ядовиты, но также и способностью этого элемента «превращать медь в серебро». Когда в расплавленную медь добавляют мышьяк, она приобретает белый цвет, становясь похожей на серебро. Выделение мышьяка в виде простого вещества традиционно связывают с именем теолога и алхимика XIII в. Альберта Великого. Русское название элемента — это, по-видимому, искажённое «мышиный яд», «мышь-яд». Латинское Arsenicum происходит от греческого наименования сернистых соединений мышьяка. «Арсеникон» по-гречески означает «сильный», «мужественный» — такую дань благоговения воздали древние исключительно ядовитым соединениям мышьяка.
Пожалуй, самое известное применение висмута — легкоплавкие сплавы на его основе. Чаше других используют сплав Вуда, содержащий 50 % висмута, 25 % свинца и по 12,5 % олова и кадмия. Плавится он уже при 69 °С, хотя каждый из исходных металлов имеет значительно более высокую температуру плавления (Bi — 271 °С, Pb — 327 °С, Sn — 232 °С, Cd — 321 °С). Подобные сплавы применяют в качестве легкоплавких припоев, предохранителей в электрической аппаратуре.
Все знают, как трудно свернуть в кольцо или спираль металлическую трубочку с тонкими стенками, не сплющив её. Если же предварительно залить в слегка разогретую трубочку сплав Вуда, то после застывания ей можно без труда придать нужную форму. А затем,
снова разогрев, вылить легкоплавкий состав.
Рассказывают о шутнике, который изготовлял из сплава Вуда чайные ложки. В руках ничего не подозревающих простаков они неожиданно стекали на дно стакана с горячим чаем.
Чтобы зафиксировать ядерные реакции, рождение и гибель элементарных частиц, используют сложные физические приборы, позволяющие увидеть это в особой среде, например в переохлаждённых парах воды или спирта. Пролетающая частица вызывает вдоль своего пути конденсацию охлаждённых паров в виде крошечных капелек тумана. В электрическом или магнитном поле следы заряженных частиц — треки — искривляются. Их можно сфотографировать. Один из таких снимков был сделан в 1952 г. Очень похожая «фотография» была получена в домашних условиях школьником из Красноярска Александром Сироткиным. Вот что рассказал юный химик:
«Фотографию „деления ядра" я сделал дома, без всяких приборов. И каждый желающий может повторить мой опыт. Нужны только порошок сурьмы да пара листов бумаги. Порошок можно приготовить из куска сурьмы, измельчив его в ступке или же разбив молотком, — ведь это вещество хрупкое. В клочок газетной бумаги размером примерно 1,5х2 см надо завернуть немного порошка и туго закрутить наподобие кулька. На пол положите лист белой бумаги. Взяв кулёк пинцетом за свободный конец, поднесите зажжённую спичку к тому месту, где находится сурьма, и не убирайте, пока она не расплавится и не начнёт окисляться, выделяя белый дым. Всё это проделывайте над чистым листом белой бумаги, на который раскалённая сурьма и должна упасть, разбегаясь огненными шариками. При этом на листе останутся следы, похожие на треки заряженных частиц. Огненные шарики сурьмы, скользящие по бумаге на газовой подушке, просто-напросто обугливают её. И пол при этом не портится — следы от горящей сурьмы легко стираются тряпкой. И всё же, конечно, лучше его не пачкать, подложив под лист бумаги фанерку или картон».
(XII в.) открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит гамбургскому алхимику-любителю Хеннигу Бранду (около 1630—1730). В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить её из большого количества мочи, предварительно собранной в солдатских казармах. При нагревании этой жидкости Бранду удалось выделить тяжёлое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Ортофосфорная кислота является трёхосновной кислотой, средней силы по первой ступени и слабой по второй и третьей.
Всем этим трём анионам (РО43-, НРО42-, Н2РО4-) соответствуют различные соли — кислые, средние или основные.
При смешении растворов хлорида кальция и ортофосфата натрия (среда сильнощелочная в результате гидролиза соли) образуется осадок основного фосфата кальция — минерал апатит:
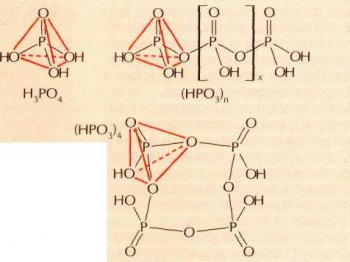
Строение ортофосфорной кислоты и метафосфорных кислот.
Оксид фосфора(IV) и фосфорную кислоту получил и исследовал немецкий химик Андреас Cuгизмунд Маргграф. Оксид фосфора (V) жадно поглощает воду, переходя в метафосфорную кислоту НРО3, — на этом основано его использование в качестве осушителя. Известно несколько метафосфорных кислот с обшей формулой (НРО3)x, где х=4 (тетраметафосфорная кислота), 6 (гексаметафосфорная кислота) или бесконечности (полиметафосфорные кислоты). При кипячении раствора метафосфорных кислот связи между отдельными фосфор-кислородными тетраэдрами разрываются, и метафосфорная кислота переходит в ортофосфорную кислоту H3PO4. В растворе для фосфорных кислот (в противоположность азотной кислоте) проявление окислительных свойств не характерно.
В теле человека массой 70 кг содержится около 780 г фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденозинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г хлеба содержится примерно 200 мг фосфора). Наиболее богаты фосфором рыба (180 мг в 100 г продукта), фасоль (540 мг на 100 г продукта), некоторые виды сыра (до 600 мг на 100 г продукта). Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальция: оптимальное соотношение этих элементов в пище составляет 1,5:1. Избыток богатой фосфором пиши приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO2, КСlО3, ВаСrO4) и восстановители (S, Sb2S3). При трении о зажигательную поверхность смесь, нанесённая на спичку, воспламеняется. Первые фосфорные спички — с головкой из белого фосфора — были созданы лишь в 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX в.
В старину для добычи селитры использовали солевые наросты, покрывавшие сырые стены каменных построек. В начале лета их соскребали, добавляли поташ и варили, а затем кристаллизовали. Из смеси нитратов аммония и кальция, содержащихся в этих наростах, образовывался нитрат калия — калийная селитра:
2NH4NO3+К2СО3®t°2KNO3+2NH3+СО2+Н2О
Ca(NO3)2+К2СО3 ®t°2KNO3+СаСО3.
Начиная с XV в. селитру стали получать из «селитряниц» — специальных ям, заполненных органическими отходами. Содержимое селитряниц, в которых образовывался нитрат аммония, подвергали варке с поташом.
Владимир Иванович Даль в «Толковом словаре живого великорусского языка» (1882 г.) даёт следующие толкования слов «селитра», «поташ» и связанных с ними понятий:
С азотной кислотой взаимодействуют практически все металлы разной химической активности (исключение составляют благородные металлы — платина, золото, рутений, родий, осмий и иридий). В отличие от других кислот, в реакциях HNO3 с металлами водород, как правило, не выделяется. Продуктами восстановления НNО3 являются оксиды азота в различных степенях окисления, свободный азот или ион аммония — в зависимости от активности металла. Состав этих продуктов определяется концентрацией кислоты (чем она выше, тем в меньшей степени протекает восстановление) и природой металла (чем активнее металл, тем полнее протекает восстановление кислоты). Следовательно, наиболее полного восстановления (до иона аммония) можно добиться, используя очень разбавленную, 1—3-процентную, азотную кислоту.
Некоторые металлы (железо, хром, алюминий) при комнатной температуре с концентрированной азотной кислотой не взаимодействуют: они пассивируются, так как на их поверхности образуется тонкая защитная плёнка соли. Даже барий, активно реагирующий с водой, может спокойно лежать на дне стакана с концентрированной азотной кислотой, поскольку покрывается коркой нитрата бария, практически нерастворимого в этой кислоте.
Глядя на литровые банки с бесцветной, ничем не примечательной жидкостью, трудно представить, какая разрушительная сила таится за стеклянными стенками. Азотная кислота — настолько сильный окислитель, что некоторые органические вещества (в частности, скипидар) при соприкосновении с ней воспламеняются.
Безводная азотная кислота HNO3 — бесцветная летучая жидкость (tкип=83 °С; из-за летучести безводную кислоту называют «дымящей») с резким запахом. В лаборатории её получают по методу Глаубера — действием на селитру концентрированной серной кислоты. При нагревании азотная кислота переходит в пар, который конденсируется в приёмнике, охлаждаемом льдом.