С азотной кислотой взаимодействуют практически все металлы разной химической активности (исключение составляют благородные металлы — платина, золото, рутений, родий, осмий и иридий). В отличие от других кислот, в реакциях HNO3 с металлами водород, как правило, не выделяется. Продуктами восстановления НNО3 являются оксиды азота в различных степенях окисления, свободный азот или ион аммония — в зависимости от активности металла. Состав этих продуктов определяется концентрацией кислоты (чем она выше, тем в меньшей степени протекает восстановление) и природой металла (чем активнее металл, тем полнее протекает восстановление кислоты). Следовательно, наиболее полного восстановления (до иона аммония) можно добиться, используя очень разбавленную, 1—3-процентную, азотную кислоту.
Некоторые металлы (железо, хром, алюминий) при комнатной температуре с концентрированной азотной кислотой не взаимодействуют: они пассивируются, так как на их поверхности образуется тонкая защитная плёнка соли. Даже барий, активно реагирующий с водой, может спокойно лежать на дне стакана с концентрированной азотной кислотой, поскольку покрывается коркой нитрата бария, практически нерастворимого в этой кислоте.
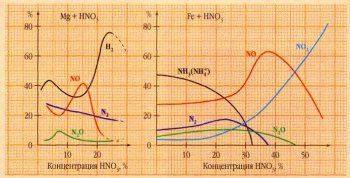
В некоторых случаях в ходе реакции выделяется и водород, причём можно подобрать условия, при которых он станет одним из главных продуктов восстановления. Так, например, смесь газов, образующаяся при взаимодействии 12,5-процентной азотной кислоты и марганца, на 86% состоит из Н2, на
Процентный состав газообразных продуктов реакции взаимодействия металла {магния, железа) с азотной кислотой разных концентраций.
13% — из NO и на 1% — из N2O. Как показали российские исследователи, водород выделяется также при реакции азотной кислоты с магнием. Азотная кислота способна окислять и некоторые неметаллы, например уголь, серу, фосфор:
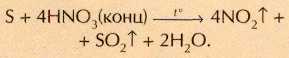
Медь энергично взаимодействует с концентрированной азотной кислотой с образованием бурого газа NO2: Cu+4HNO3 (конц)=Cu(NO3)2+2NO+2Н2О.

Похожие статьи