Глядя на литровые банки с бесцветной, ничем не примечательной жидкостью, трудно представить, какая разрушительная сила таится за стеклянными стенками. Азотная кислота — настолько сильный окислитель, что некоторые органические вещества (в частности, скипидар) при соприкосновении с ней воспламеняются.
Безводная азотная кислота HNO3 — бесцветная летучая жидкость (tкип=83 °С; из-за летучести безводную кислоту называют «дымящей») с резким запахом. В лаборатории её получают по методу Глаубера — действием на селитру концентрированной серной кислоты. При нагревании азотная кислота переходит в пар, который конденсируется в приёмнике, охлаждаемом льдом.
Азотная кислота — сильная: в водном растворе она полностью распадается на ионы. На практике обычно пользуются 68-процентным раствором, называемым концентрированной азотной кислотой (tкип =121 °С).
Ампула с N2O3.
Азотную кислоту используют для производства минеральных удобрений, медикаментов, взрывчатых веществ, в качестве окислителя в лабораторной практике. Промышленное производство кислоты основано на каталитическом окислении аммиака до оксида азота(П), последующем его окислении кислородом до оксида азотa (IV) и взаимодействии его с водой.
Соли азотной кислоты (нитраты) применяют в качестве азотных удобрений. Хотя смертельная доза нитратов для человека колеблется от 8 до 15 г, их суточное потребление не должно превышать 5 мг в расчёте на килограмм массы тела. Внесение в почву избыточных количеств азотных удобрений приводит к страшным последствиям. Весной, когда тает снег, нитраты из почвы попадают в источники питьевой воды — реки и озёра, — ведь все они прекрасно растворимы. Кроме того, нитраты могут накапливаться в корнеплодах и плодах некоторых овощных культур (моркови, свёкле, арбузах, дынях, картофеле и т. д.). Такими овощами можно серьёзно отравиться, так как в организме нитраты восстанавливаются до ещё более ядовитых нитрозаминов R2N—N=O.
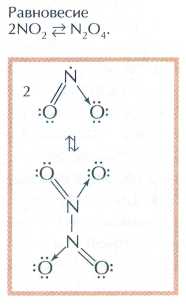
Похожие статьи