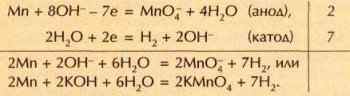Считается, что первые в истории человечества монеты были отчеканены в VII в. до н. э. в Лидийском царстве из электрума — природного сплава золота с серебром, содержащего до 30% серебра. В последующие века основными монетными металлами стали золото, серебро и медь.
Во второй половине XIX в. к этим трём металлам добавился и четвёртый — никель. Из чистого никеля отчеканены, например, современные 50-франковые бельгийские монеты. Но чаше используют медно-никелевый сплав. Интересно, что в древней Бактрии делали монеты из почти современного медно-никелевого сплава, содержащего 20 % никеля. Этот состав соответствовал естественным рудным залежам.
Случаи использования для изготовления монет других металлов VIII группы немногочисленны. В Византии, а также в средневековом Китае и Японии в ходу были железные деньги. Сегодня из железа (вернее, из стали) отчеканены монеты Боливии, Бразилии, Нидерландов, Индии, Италии и других стран, а также российские и украинские копейки и пятачки. Стальные монеты стойки к истиранию, часто в них есть
легирующие добавки хрома. Так, некоторые итальянские монеты содержат 18,25% хрома, украинские — 16,82%. Монеты из чистого железа выпускались в Люксембурге и Финляндии.
По сравнению с испокон веков известным человеку железом, его соседи по периодической системе, кобальт и никель, были открыты, можно сказать, совсем недавно.
История кобальта как химического элемента началась в Саксонии, на серебряных рудниках. Иногда из руды, очень похожей на серебряную, не удавалось получить желанный металл, а при её обжиге выделялся ядовитый газ. В таком случае говорили, что рудокопы потревожили злого духа Коболда. В 1735 г. шведский химик Георг Брандт (1694— 17б8) установил, что в «злом» минерале содержатся мышьяк (поэтому при обжиге выделялись ядовитые пары As2O3) и неизвестный металл. Брандт выделил его и сохранил за ним название «кобальт».
На уроках химии, на лекциях часто показывают эффектный опыт горения стальной проволоки в чистом кислороде. К счастью, в атмосфере Земли кислород составляет лишь пятую часть, поэтому горение железных и стальных изделий сильно замедляется. Но не прекращается! Этот незримый пожар, который называется коррозией, ежегодно разрушает десятки миллионов тонн выплавляемого металла. Коррозия не просто уничтожает металл, на выплавку которого были затрачены огромные усилия. Она выводит из строя готовые изделия, а их стоимость неизмеримо выше стоимости самого металла. Коррозия не щадит ни миниатюрные точные детали, ни огромные мосты.
Особенно опасна она в тех местах, где металл находится под нагрузкой. Если с помощью мощного пресса немного сплющить стальные шарики от подшипников, а затем эти шарики, находящиеся под сильным внутренним напряжением, поместить в разбавленный раствор соляной кислоты, то через некоторое время, когда кислота разъест поверхностный слой, энергия напряжения внезапно освобождается, и шарики взрываются с громким звуком.
С конца XVIII до середины XIX в. сталь получали пудлинговым методом (от англ. puddle— «месить»). Чугун переплавляли в печах, выложенных железной рудой. Чтобы содержащиеся в руде примеси быстрее окислялись кислородом воздуха, работник-пудлинговщик помешивал плав железной клюкой. Метод был очень трудоёмкий и малопроизводительный, хотя и давал сталь достаточно высокого качества.
В 1856 г. английский изобретатель Генри Бессемер создал конвертор — грушевидную вращающуюся печь, выложенную изнутри кварцевыми огнеупорами. В печь, расположенную горизонтально, заливали расплавленный чугун, подавали сжатый воздух, и затем ставили её вертикально. Кислород частично окислял железо до оксида FeO, который, растворяясь в жидком чугуне, окислял углерод, кремний и марганец. Производительность конвертора была достаточно высокой, несмотря на то что в нём не происходило удаления примесей фосфора.
Английский металлург Сидни Джилкрист Томас заменил кварцевые огнеупоры на жжёные доломитные, содержащие оксиды кальция и магния. В процессе передела чугуна эти оксиды связывали фосфорные примеси (в виде Р2О5) в фосфаты, которые удалялись из стали в виде шлаков. Такой конвертор стали называть томасовским, в отличие от бессемеровского.
Рений встречается в виде примеси в рудах некоторых металлов. Например, отдельные молибденовые руды содержат до 100 г рения на тонну руды. По меркам исследователей, этого уже достаточно, чтобы организовать его производство.
В наши дни мировая промышленность потребляет 10—15 т рения в год, а цена его в конце 80-х гг. XX в. составляла 1500 долларов за 1 кг. Удивительно, что такой редкий металл, как рений, стоит в несколько раз дешевле золота. Может быть, это связано с тем, что рений ещё не нашёл достойного применения?
Общие запасы этого элемента на Земле оцениваются примерно в 2,5 тыс. тонн.
Технеций и рений были открыты значительно позже марганца, хотя существование элементов с порядковыми номерами 43 и 75 предсказал ещё
Д. И. Менделеев. Он дал им названия «экамарганец» и «двимарганец», что означает «первый и второй аналоги марганца». Однако судьба распорядилась так, что сначала выделили «второй марганец» и лишь потом — «первый». Честь открытия двимарганца принадлежит немецким учёным Вальтеру Ноддаку (1892—1960) и Иде Такке (в замужестве Ноддак; 1896— 1978), обнаружившим в 1925 г. его следы в минералах редкоземельных элементов.
Они назвали новый элемент рением, желая увековечить тем самым имя родины Такке — Рейнской провинции. К 1926 г. им удалось выделить всего... 2 мг металла!
В 1928 г. после переработки 660 кг молибденита MoS2 был получен первый грамм рения, стоимость которого составила свыше 30 000 золотых марок! Но уже к 1930 г. количество добытого рения стало исчисляться килограммами, цена же его упала до 13 марок за грамм, а к 1935 г. — до 6,5 марок.
Предсказанный Менделеевым экамарганец в течение многих лет оставался для химиков загадкой, элементом-«невидимкой». Его ошибочно открывали много раз, и лишь в 1937 г. элемент № 43 был синтезирован в циклотроне (ускорителе частиц) при облучении молибдена ядрами дейтерия. Само название, которое технеций получил спустя десять лет, говорит о том, что он искусственный, созданный руками человека. Теперь технеций в большом количестве (сотни килограммов) получают из продуктов деления урана в ядерных реакциях.
Все изотопы технеция радиоактивны, и время их жизни относительно невелико (лишь у некоторых изотопов — 97Тс, 98Тс — период полураспада составляет величину порядка 106 лет), поэтому в природе его соединения практически отсутствуют.
Металлический технеций при комнатной температуре устойчив к окислению, не корродирует в морской воде. Одним словом, у него много достоинств. А вот радиоактивность и высокая стоимость металла — главные недостатки, которые препятствуют его практическому использованию.
Перманганат калия — очень сильный окислитель. Он может реагировать со многими неорганическими и органическими соединениями. Чем больше электронов способен принять окислитель в ходе реакции, тем большее количество молей другого вещества он окислит. Число электронов, переходящих к окислителю, зависит от условий проведения реакции, например от кислотности среды. Так, в нейтральной или слабощелочной среде перманганат-ион восстанавливается до оксида марганца (IV): MnО4+2Н2О+3е=MnО2+4ОН-. Но особенно ярко окисляющая способность перманганата проявляется в кислой среде: MnО-4+8Н++5е=Mn2++4Н2О. Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, сильно загрязнённой плохо смываемыми остатками органических веществ.
В домашних условиях тоже можно использовать перманганат калия (марганцовку) для пользы дела, например чтобы почистить фаянсовую раковину в ванной. Вообще-то есть специальные порошки и пасты, но будет неплохо, если юный химик докажет, что результатом его домашних опытов могут стать не только прожжённые брюки и пятна на полу.
В промышленности перманганат калия (марганцовку) получают электролизом концентрированного раствора гидроксида калия с марганцевым анодом. В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы. На катоде происходит выделение водорода. Схему электролиза можно представить в виде уравнений реакций:
Умеренно растворимый в воде перманганат калия выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить NaMnO4 невозможно: в отличие от перманганата калия, он прекрасно растворим в воде (при 20 °С его растворимость составляет 144 г на 100 г воды).
В течение долгого времени белую магнезию MgCO3 и чёрную магнезию (пиролюзит) MnO2 считали минералами, содержащими один и тот же металл. Потом из-за внешнего сходства чёрной магнезии и магнитного железняка Fe3O4 стали полагать, что чёрная магнезия — минерал железа. Первое серьёзное научное исследование, проведённое К В. Шееле в 1774 г., показало, что в состав этого вещества входит новый элемент. В том же году Ю. Ган, восстановив чёрную магнезию углём, выделил его в виде простого вещества. Сначала элемент назвали Magnesium (от старинного латинского названия пиролюзита lapis magnesis, затем переименовали в Manganesium). И лишь когда Г. Дэви выделил новый металл магний (Magnesium), во избежание путаницы с марганцем название последнего изменили на Manganum.
Марганец недаром считается химическим хамелеоном: известно большое число соединений, в которых он проявляет все промежуточные степени окисления от 0 до +7. А окраска этих соединений составляет богатейшую палитру: соли марганца(П) — нежного бледно-розового цвета, соединения марганца (III) — коричневые или вишнёвые, марганца (IV) — чёрные или коричневые, марганца (V) — ярко-синие, марганца (VI) — зелёные, а марганца (VII) — малиновые.