Свободно конвертируемая валюта — вовсе не признак только нашего времени. Но представить себе, что всеобщей мерой ценностей когда-то было железо, мы можем с большим трудом. А между тем во времена Гомера «одни покупали вещи на бычьи шкуры, другие — на железо и пленных», как
Железо в старину получали «сыродутным» способом. Железную руду и уголь загружали в печи, имевшие форму длинной трубы. Уголь поджигали, а ветер, дующий в трубу, поддерживал высокую температуру (около 1400 °С), необходимую для восстановления железа из оксидной руды. Полученный металл (крицу) ковали, в процессе ковки от него отделялись куски шлака, и оставалось чистое железо. В некоторых странах этим способом металл выплавляли вплоть до XVIII в.
писал Плиний Старший. Одна часть железа приравнивалась к десяти частям золота. Почему же железо ценилось так высоко? Наверное, причин две. Во-первых, оно было самым прочным из известных тогда металлов, незаменимым при изготовлении оружия и орудий труда. Вторая причина — сложность добычи железа.
Железо в брикетах.
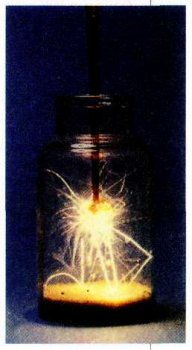
При горении стальной проволоки в кислороде образуется железная окалина: 3Fe+2О2=Fe3O4.
В Средневековье благодаря использованию воздушных мехов температуру внутри печей удалось повысить настолько, что металл в них плавился. Чистое железо плавится при 1535 °С, однако при содержании всего 4,3% углерода температура плавления снижается до 1135 °С. Расплавленный металл не только растворял значительное количество углерода, но и взаимодействовал с ним с образованием карбида Fe3C (цементита). При охлаждении расплава избыточный углерод кристаллизовался в виде графита. Так вместо ковкого железа люди получили чугун — сплав, содержащий 2,5—5% углерода. Чугун использовали для литья пушек, ядер и даже для изготовления посуды. В отличие от железа, чугун хрупок, как стекло. Чтобы сделать его ковким, надо было снизить содержание углерода до 0,3—1,7%. Дkя этого над расплавленным чугуном пропускали воздух, и углерод выгорал, образуя оксиды СО и СО2. Чугун превращался в сталь.
Плавильная печь с передним горном. Гравюра из книги Г. Arриколы «О горном деле и металлургии». Издание 1557 г. Стенки печи А выполнены из камня. Сверху в неё загружают руду и уголь. Сзади печи расположены меха (на гравюре не видны), через которые с помощью специальных приспособлений, например водяного колеса, вдувают воздух. Один из работников на тележке подвозит руду, другой загружает её в печь, третий выпускает из печи металл в горн В — специальное углубление в земле, наполненное песком.
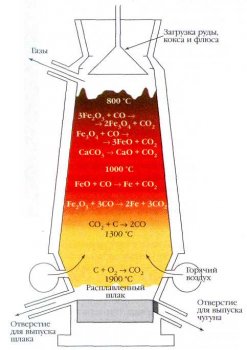
Домна представляет собой печь высотой 20—25 м, выложенную огнеупорным кирпичом. Сверху в неё загружают кокс и измельчённую железную руду, а снизу под давлением подают воздух. От теплоты, выделяющейся в ходе реакции, образующийся чугун плавится и стекает вниз. Для удаления содержащихся в руде примесей (например, кремнезёма SiO2) в печь добавляют флюсы — известняк СаСО3 или доломит СаСО3•MgCO3. Получающиеся при их разложении оксиды переводят кремнезём в легкоплавкие шлаки: СаО+SiO2=CaSiO3, которые собираются над расплавленным чугуном, предохраняя его от окисления. Чугун и шлаки выпускают из домны через отверстия, расположенные на разных уровнях.
Нож из дамасской стали.
Казалось бы, подобная технология не могла обеспечить высокого качества металла. И всё же именно таким способом на Востоке получали знаменитую дамасскую сталь! Секрет дамасской стали оберегался настолько тщательно, что раскрыть его удалось
только в конце XIX в. И заключается он не в специальных добавках, а в особенностях обработки. При выплавке такой стали нужен хороший доступ воздуха, чтобы все примеси серы, кремния и фосфора перешли в шлаки. А затем плав необходимо очень медленно охлаждать. Тогда процесс затвердевания сопровождается образованием разветвлённых кристаллов-дендритов (от греч. «дендрон» — «дерево»), что делает сталь вязкой и тугоплавкой, а пространство между ними заполняется богатыми углеродом компонентами, имеющими очень высокую твёрдость.
В наши дни чугун выплавляют из руды в специальных печах — домнах, а чтобы получить из него сталь, используют установки, называемые конверторами (от англ. convert — «переделывать», «преобразовывать»).
Оксид железа (II) FeO, магнитный железняк (магнетит) Fe3O4 и красный железняк (гематит) Fe2O3 (в чашке).
В конверторах через расплавленный чугун с добавками руды или ржавого металлического лома продувают воздух. При этом углерод окисляется до угарного газа, который восстанавливает оксид железа (руду и прокалённую ржавчину) до металла:
4Fe3C+11О2=6Fe2O3+4CO Fe2O3+ЗСО=2Fe+3СО2.
Но и железо также частично окисляется до оксида FeO. После того как все примеси, содержавшиеся в чугуне (С, Si, P и др.), окислились кислородом, в сталь вводят раскислители — активные металлы (Mn, Al, La), которые восстанавливают FeO до металла. Образующиеся при этом оксиды реагируют с кремнезёмом, превращаясь в шлаки: MnO+SiO2=MnSiO3.
Железный купорос FeSO4 •7Н2О.
В последнее время все большее применение находит гораздо более экономичный «прямой» метод получения железа. Он основан на восстановлении оксидов железа природным газом (метаном СН4): Fe3O4+СН4=3Fe+СО2+2Н2О. Затем железо переплавляют в электропечах, при необходимости вводя легирующие добавки, в основном хром или марганец. Таким образом можно получать сталь высокого качества, минуя стадии выплавки чугуна и его передела.
Получить железо — это полдела. Следующая задача — защитить металл от коррозии. Ежегодно от неё «погибает» 15—20% всех изделий из железа. Железо — активный металл, и на влажном воздухе оно окисляется, превращаясь в оксид-гидроксид железа (III), проще говоря, в ржавчину:
4Fe+2Н2О+3О2=4FeO(OH).
Ржавчина — очень рыхлое вещество, поэтому влага и кислород легко проникают сквозь неё и продолжают уничтожать железо. Чтобы предотвратить коррозию, применяют различные покрытия. Обычно используют цинк — металл более активный, чем железо (см. статью «Трое из батарейки»). Другой тип защитных покрытий — полимеры. Чаще всего это лаки и краски, основой которых служат масла и синтетические смолы. При их высыхании образуется очень плотная плёнка, препятствующая проникновению влаги к поверхности металла. Для борьбы с коррозией применяют и ингибиторы (от лат. inhibere — «сдерживать», «останавливать») — вещества, которые подавляют окисление железа, хотя механизм их действия однозначно не установлен.
Нержавеющая сталь, содержащая от 12 до 30% хрома, не подвержена коррозии, устойчива к действию кислот и щелочей. К сожалению, она значительно дороже обычной.
Железо легко вступает в реакцию с растворами кислот, но на холоду практически не реагирует с концентрированными серной и азотной кислотами. Причина в том, что на поверхности металла образуется тончайший и очень плотный слой оксида Fe3O4. Поэтому концентрированные серную и азотную кислоты перевозят в стальных цистернах.
При растворении железа в растворах кислот образуются соли железа (П): Fe+2HCl=FeCl2+H2, а при горении металла в хлоре — соединения железа(Ш): 2Fe+3Сl2=2FeCl3.
Бесцветный гидроксид железа (II) проявляет только основные свойства: он легко растворяется в кислотах. На воздухе Fe(OH)2 быстро окисляется, превращаясь в жёлто-коричневый гидроксид железа(Ш). В отличие от Fe(OH)2, он амфотерен, хотя его кислотные свойства выражены намного слабее основных; он растворяется только в концентрированных щелочах при нагревании: Fe(OH)3+3КОН=K3[Fe(OH)6].
Достоверно установленная максимальная степень окисления железа +6. Примером может служить реакция Fe(OH)3 с сильным окислителем, например с бромом, в щелочной среде; при этом образуется вишнёвый раствор феррата:
2Fe(OH)3+3Br2 +10КОН=2K2FeO4+6KBr+8Н2О.
Ферраты — очень сильные окислители, в кислых растворах они окисляют даже воду с выделением кислорода:
4K2FeO4+10H2SO4=4K2SO4+2Fe2(SO4)3+3O2+10H2O.
Источник: Мир Энциклопедий Аванта+
Авторы: Андрей Дроздов, Илья Леенсон, Дмитрий Трифонов, Денис Жилин, Александр Серов, Андрей Бреев, Андрей Шевельков, Вадим Ерёмин, Юлия Яковлева, Оксана Рыжова, Виктория Предеина, Наталья Морозова, Алексей Галин, Сергей Каргов, Сергей Бердоносов, Александр Сигеев, Оксана Помаз, Григорий Середа, Владимир Тюрин, Антон Максимов, Вячеслав Загорский, Леонид Каневский, Александр Скундин, Борис Сумм, Игнат Шилов, Екатерина Менделеева, Валерий Лунин, Абрам Блох, Пётр Зоркий, Александр Кури, Екатерина Иванова, Дмитрий Чаркин, Сергей Вацадзе, Григорий Серела, Анастасия Ростоцкая, Александр Серое, Анастасия Сигеева
Авторское право на материал
Копирование материалов допускается только с указанием активной ссылки на статью!
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.





Похожие статьи