Элементы с порядковыми номерами 99 и 100 были открыты в ноябре 1952 г., когда американцы осуществили термоядерный взрыв на коралловом острове Бикини в южной части Тихого океана. В результате взрыва возникло радиоактивное облако диаметром примерно 200 км. В эпицентр были направлены беспилотные радиоуправляемые самолёты. Полученные с них данные указывали на то, что часть атомов урана, входившего в состав термоядерного устройства, захватили до 17 нейтронов. Радиоактивный распад образовавшихся при этом сверхтяжёлых изотопов урана последовательно порождал трансурановые элементы, вплоть до элементов с порядковыми номерами 99 и 100. Чтобы выделить возможно большее их количество, исследователям пришлось переработать тонны кораллов, собранных в районе взрыва. Впоследствии эти элементы удалось получить и в ядерном реакторе. Они были названы эйнштейнием (Es) и фермием (Fm).
Вторую сотню химических элементов в таблице Менделеева открывает элемент, названный в честь её создателя. Увлекательную и захватывающую историю открытия 101-го элемента рассказали Альфред Гиорсо, Беруэлл Харви, Грегори Чоппин и Стенли Томпсон — сотрудники Гленна Сиборга, получившего в 1951 г. Нобелевскую премию за изучение химических свойств трансурановых элементов.
«Новый элемент — менделевий был получен путём бомбардировки эйнштейния, 99-го элемента, ядрами гелия. Ядерная реакция предельно проста: 25399Es+42He ®256101Md+10n. Мы осуществили её в циклотроне, где пучок ядер гелия ударяется о небольшую мишень. Мишень — это кусочек очень тонкой золотой фольги, на заднюю поверхность которой нанесён электролитическим способом неразличимый простым глазом слой эйнштейния — не более, чем несколько миллиардов атомов. Если некоторые атомы эйнштейния превратятся в результате бомбардировки в менделевий, то они должны покинуть мишень, будучи выбиты из неё при соударении с ядрами гелия. Позади мишени расположена ещё одна золотая фольга, которая захватывает атомы нового элемента, как только они вылетают из мишени. Ядра гелия, обладающие большой скоростью, были получены на старом полутораметровом циклотроне, расположенном на спортивной площадке Калифорнийского университета в Беркли. Если позволить мощному потоку ядер гелия пройти мимо мишени и вырваться наружу, в воздух, то его можно увидеть — это узкий голубой пучок света. Его даже можно сфотографировать через полутораметровый слой воды, который служит смотровым окном, ведущим в помещение, где расположен циклотрон. Это и есть тот самый пучок, который падает на мишень и, прибавляя два протона гелия к 99 протонам эйнштейния, превращает последний в менделевий.
Большие надежды как на перспективное ядерное топливо в своё время возлагались на изотоп калифорния 251Cf, который по ядерным свойствам близок урану-235. Однако практический интерес к нему остыл после того, как была определена критическая масса этого изотопа: она составляет всего... 10 г. Мощность происходящего при такой массе миниатюрного ядерного взрыва может быть использована лишь в специальных пулях или снарядах.
Природный уран представляет собой смесь трёх изотопов: 235U (0,72%), 238U (99,274%) и 234U (0,006%). Для нужд ядерной техники часто необходим уран, обогащённый изотопом 235U.
Урановая руда и оксид ypaнa(IV).
Это ставит перед исследователями нелёгкую задачу разделения изотопов. В промышленности наибольшее распространение приобрёл газодиффузионный метод, основанный на неодинаковой скорости диффузии (проникновения) частиц с различной массой через пористую перегородку — мембрану. Для выделения изотопа 235U весь металл переводят во фторид UF6 — легколетучее кристаллическое вещество. Процесс разделения повторяют многократно с помощью специального каскада с большим числом ячеек, содержащих пористые перегородки. Для обогащения урана изотопом 235 от исходного его содержания в природной смеси до 95% требуется каскад в 5 тыс. ступеней.
Уран принадлежит к числу редких элементов. Однако в земной коре его 2•10-4%, т. е. больше, чем кадмия, серебра, ртути и висмута. Известно около 200 минералов урана, большинство из них — оксиды переменного состава или сложные уранаты (например, карнотит К2О•2UO3•V2O5•3Н2О, названный в честь французского горного инженера М. А. Карно). Небольшое количество урана содержится также во фторапатите Са5(РО4)3(ОН, F), монаците, некоторых глинах и сортах гранита. Простейший минерал — уранинит UO2+x, Это диоксид урана, подвергшийся частичному окислению кислородом воздуха либо кислородом, выделившимся в результате перестройки структуры оксида UO2 при радиоактивном превращении урана в свинец: при этом образуется оксид PbО, а избыточный кислород, выделяющийся в свободном виде, окисляет уран. Урановая руда считается богатой, если содержит от 0,5 до 1% урана. На заводах по переработке урановых руд уранинит обогащают, а затем отделяют уран от примесей и выделяют в виде оксида UO2.
Для получения металлического урана диоксид переводят в тетрафторид: UO2+4HF=UF4+2H2O и потом восстанавливают металлотёрмически: UF4+2Mg®t°U+2MgF2. Возникает вопрос: зачем надо превращать оксид во фторид, если уран можно получать и напрямую из оксида, восстанавливая его кальцием или магнием? Восстановление из фторида предпочтительнее, потому что только в этом случае выделяющегося в ходе реакции тепла достаточно для расплавления и металла, и шлака. Когда расплав охлаждают, образуется слиток урана. А при восстановлении оксида уран получается в виде порошка, который трудно отделить от шлака.
Актиниды — тугоплавкие металлы серебристого цвета. Как и 4f-элементы, они обладают высокой химической активностью. Однако, по сравнению с лантанидами, между отдельными представителями семейства актинидов различий больше: у каждого из них свои особенности. Из всех представителей семейства наибольшее практическое значение имеет уран. Одно время, на заре ядерных исследований, XX век называли даже веком урана.
По внешнему виду уран напоминает сталь: легко поддаётся ковке, полировке, прокатке, тугоплавок (tпл=1130 °С). Уран — плохой проводник тепла и электричества: его теплопроводность в 13 раз меньше теплопроводности меди.
Трансурановыми называют элементы, расположенные в периодической системе за ураном, т. е. имеющие порядковый номер больше 92.
В отличие от лантанидов, все 5f-элементы радиоактивны, т. е. не имеют стабильных изотопов. И если для тория и урана существуют изотопы, период полураспада которых измеряется миллиардами лет, то время жизни трансурановых, т. е. следующих за ураном, элементов, как правило, уменьшается с увеличением порядкового номера. Очевидно, что если элемент живёт лишь доли секунды,
это создаёт значительные трудности в изучении его химических свойств.
Из всего семейства актинидов в природе в заметном количестве встречаются лишь торий и уран, находящиеся в начале ряда. Остальные элементы являются искусственными, синтезированными человеком. Одни из трансурановых элементов выделены в количествах сотен тонн (Pu), для других массы исчисляются граммами или даже микрограммами, а некоторые получены лишь в количестве нескольких атомов.
Оксид урана U3O8, выделенный в 1789 г. немецким химиком Мартином Клапротом из урановой смоляной руды (урановой смолки), долгое время считали простым веществом. Ему присвоили имя планеты, открытой за восемь лет до этого.
Металлический уран впервые удалось получить в 1841 г. французскому учёному Эжену Пелиго (1811 — 1890) восстановлением тетрахлорида урана калием: UCl4+4К=U+4КCl. Аналогичным образом Берцелиусом в 1828 г. был получен торий, названный в честь Тора — бога-громовержца в скандинавской мифологии.
Сейчас трудно представить нашу жизнь без электричества. Однако ещё не так давно к фонарям на улицах тянулись не провода или электрические кабели, а трубы с газом. Газовое освещение появилось в начале XIX в. Светильный газ получали перегонкой каменного угля или древесины без доступа воздуха, и подобное производство являлось мощной отраслью промышленности.
Вообще-то сам по себе горящий газ даёт мало света. Резко увеличить освещённость горелки можно, поместив в пламя подходящее вещество, которое, разогреваясь, начинает само светиться. Вначале таким усилителем, «рабочим телом» служила платиновая проволока, но подобные горелки были очень дороги.
Настоящую революцию в осветительном деле совершил австрийский химик Карл Ауэр (1858—1929). Кстати, основные его исследования посвящены изучению редкоземельных элементов. Работая в лаборатории немецкого химика Роберта Бунзена, Ауэр заметил: если тугоплавкие оксиды редкоземельных элементов нагреть в пламени горелки, они начинают ярко светиться. Учёный начал интенсивно работать над усовершенствованием газовой горелки.
В старых учебниках по химии можно найти любопытное упоминание о церии — металле, который обладает удивительным свойством: если проволоку из него поскрести ножом, то образующиеся при этом мельчайшие пылинки самовоспламеняются на воздухе (такое свойство металла называется пирофорностью — от греч. «пир» — «огонь» и «форос» — «несущий»). Если же внести в пламя саму цериевую проволоку, она вспыхивает ослепительным огнём, превосходя по яркости горящий магний.
Необычное свойство церия использовал австрийский химик Карл Ауэр фон Вельсбах, разработав состав для «кремнёвых» зажигалок. В его основе — сплав церия с другими редкоземельными металлами (мишметалл — от нем. mischen— «смешивать»), образующийся при восстановлении смеси их оксидов кальцием. Небольшой кусочек подобного вещества при ударе (или энергичном трении о стальное колесико) даёт множество искр, которые легко поджигают фитиль. Для кремней зажигалок оптимален такой состав: Ce — 66%, Fe — 25%, La — 8%, Mg — 0,5%, Cu — 0,5%. Зажигалки позволили сэкономить огромное количество спичек.
Аналогичный сплав на основе церия используется также в трассирующих (светящихся) пулях и снарядах. Специальная насадка из пирофорного сплава надета на снаряд снаружи, а роль колёсика в зажигалке, высекающего искру, здесь играет воздух. При больших скоростях трение насадки о воздух заставляет снаряд искрить, в результате чего ночью легко проследить его путь к цели.
Оксиды некоторых лантанидов используют как катализаторы крекинга нефти (см. статью «Нефть. Метаморфозы»), а также для окраски стёкол: добавка оксида неодима придаёт стеклу фиолетовый оттенок, эрбия — розовый, празеодима — зелёный, церия (IV) — жёлтый. Соединения на основе сульфидов (Ln2S3) и оксисульфидов (Ln2O2S) редкоземельных элементов служат люминофорами в экранах цветных телевизоров и дисплеях компьютеров. В галогенные лампы вводят люминофоры на основе иодидов лантанидов. Они дают люминесцентное свечение разных цветов. Лантан и лантаниды — тугоплавкие металлы серебристо-белого цвета
Наиболее сильно ферромагнитные свойства выражены не у индивидуальных простых веществ, а у сплавов лантанидов с ферромагнитными металлами. При сплавлении металлов иногда образуются химические соединения — интерметаллиды. Примером может служить SmCo5. На основе этого и подобных ему соединений в наше время изготовлены наиболее мощные постоянные магниты: сравнительно небольшой магнит, который умещается на ладони, способен удержать легковой автомобиль вместе с пассажирами!
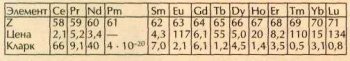
Так как у лантанидов наружные электронные оболочки построены одинаково, их химические свойства весьма сходны. Казалось бы, и встречаться в природе, и цениться они должны тоже одинаково. Однако таблица цен и распространённости лантанидов показывает, что это не так:
Во второй строке таблицы приведён порядковый номер элемента Z, в третьей — округлённая цена в долларах за 1 г металла в слитке чистотой 99,9 % (в ценах 2000 г. компании «Олдрич»). В графе прометия стоит прочерк: у этого элемента нет стабильных изотопов, один из самых долгоживущих — прометий-147 (период полураспада 2,62 года) — получают искусственно и используют в миниатюрных атомных батарейках. В 1998 г. 1 г 147Pm стоил примерно 10 млрд. долларов. Конечно, никто прометий граммами (и даже микрограммами) не покупает: его количество измеряют единицами активности — беккерелями и мегабеккерелями; для 147Pm 1МБк соответствует 3•10-9 г прометия.
Сплавы некоторых редкоземельных элементов с переходными металлами (например, LaNi5) способны поглотить в 1,5 — 2 раза больше водорода, чем его содержится в таком же объёме жидкого водорода. Это объясняется тем, что, попадая в пустоты кристаллической решётки металла, молекулы водорода распадаются на атомы, образующие связи с атомами металлов. А при незначительном нагревании сплав, насыщенный водородом, легко его отдаёт. На основе LaNi5 уже разработаны аккумуляторы водорода, которые могут использоваться при развитии водородной энергетики.