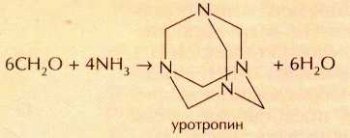
В 1860 г. А. М. Бутлеров обнаружил, что взаимодействие водных растворов аммиака и формальдегида приводит к образованию белого кристаллического вещества — уротропина (гексаметилентетрамина C6H12N4):
Атомы углерода и азота в молекуле уротропина расположены в пространстве так же, как атомы углерода в элементарной ячейке алмаза.
Это вещество используется как «сухое горючее» (так называемый твёрдый спирт), а также входит в состав некоторых лекарств.
Своему широкому распространению в природе амины — органические соединения, включающие NH2-группу, обязаны белкам: в аминокислотах, входящих в их состав, всегда содержится аминогруппа. Именно она наделяет белковую молекулу свойствами, обеспечивающими функционирование живых организмов (см. статью «Азбука живой материи. Белки»). В природе низшие алифатические амины образуются при гниении белков. Например, запах тухлой рыбы обусловлен триметиламином, а 1,4-диаминобутан (путресцин, от англ. putrescence — «гниение») и 1,5-диаминопентан (кадаверин, от лат. cadaver — «труп») — действующие начала трупного запаха.
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3—15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию — раствор с концентрацией уже 70—80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH3COOHNa+H2SO4 (конц.)= CH3COOH+NaHSO4.
В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»). Впоследствии энтомологи — специалисты по насекомым (от греч. «энтомон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьев в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает.
Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название — алкоголь (араб. «ал-кугул»).
Метиловый спирт очень опасен для человека. Всего лишь 10—20 мл этого вещества могут вызвать слепоту и даже смерть. Виной тому — ещё более ядовитый формальдегид СН2О, который образуется в организме при окислении метанола. Как ни странно, но при отравлении метанолом противоядием служит... этиловый спирт. Дело в том, что в организме различные спирты превращаются в альдегиды под действием одного и того же фермента — алкогольдегидрогеназы, отщепляющей от алкоголя водород. Этиловый спирт отвлекает на себя некоторое количество алкогольдегидрогеназы и тем самым замедляет образование формальдегида. Различить этиловый и метиловый спирты можно с помощью иодоформной пробы. Иодоформ CHI3 выделяется в виде светло-жёлтого осадка при действии на этиловый спирт иода в присутствии щёлочи. Если к 1 мл спирта добавить несколько капель иодной настойки, а затем водный раствор щёлочи, то выпадение жёлтого осадка свидетельствует о том, что это этиловый спирт:
Неумеренное потребление алкогольных напитков приводит к алкоголизму — физической и психологической зависимости человека от винного спирта. По своему химическому механизму алкоголизм представляет собой частный случай наркотической зависимости, т. е. нарушения тех или иных звеньев обмена веществ. В малых дозах винный спирт постоянно присутствует в организме, но в этом нет ничего страшного, потому что ферментативные системы поддерживают равновесие между этанолом и продуктом его окисления — сильным ядом ацетальдегидом СН3ОСНО, который обезвреживается печенью. А вот если алкоголя выпито много, в организме образуется избыток ацетальдегида, и печень трудится без устали до тех пор, пока в конце концов не восстанавливается равновесие. Но такая нагрузка на печень очень часто приводит к серьёзным заболеваниям.
В незначительном количестве этилен содержится во многих тканях растений, но больше всего его в плодах, где он образуется в результате распада некоторых карбоновых кислот (линолевой кислоты) и аминокислот (метионина, аланина) под действием различных ферментов. Как оказалось, этилен способствует созреванию плодов и вызывает опадение листьев. Наиболее активно он вырабатывается в период созревания: так, 1 кг зелёных яблок выделяет около 130 мл этого газа, в то время как 1 кг спелых плодов — 110 мл, а перезрелых — всего 10 мл. Механизм физиологического действия этилена ещё до конца не изучен, однако предполагается, что он участвует в активации некоторых ферментов растений.
Если ввести в атмосферу овощехранилища небольшое количество этилена, плоды будут созревать быстрее. И наоборот, чтобы сохранить спелые плоды в течение длительного времени, надо почаще проветривать овощехранилища, удаляя не только тепло, которое выделяют овощи и фрукты при хранении, но и образующийся этилен.
По сравнению с насыщенными углеводородами алкены легко окисляются, например раствором перманганата калия или хромовой смесью (раствор дихромата калия К2Сr2О7 в концентрированной серной кислоте). Состав образующихся продуктов в очень большой степени зависит от условий протекания процесса и от природы окислителя. Как установил русский химик Егор Егорович Вагнер (1849—1903), продуктом окисления этилена однопроцентным раствором КМnО4 в нейтральной среде является двухатомный спирт этиленгликоль:
ЗСН2=СН2+2КМnО4+4Н2О®3СН2ОН— СН2ОН+2MnO2+2KOH.
Эта реакция, носящая имя Вагнера, приводит к обесцвечиванию раствора перманганата калия и используется для обнаружения в молекуле кратной связи углерод-углерод. Обесцвечивание бромной воды также служит качественной реакцией на двойную связь.
Открытие этилена имеет давнюю историю. Образование бесцветного горючего газа при действии концентрированной серной кислоты на винный (этиловый) спирт впервые описал в 1669 г. немецкий химик и врач Иоганн Иоахим Бехер (1635—1682). Эту реакцию и в наши дни используют в качестве лабораторного метода получения этилена. В 1 790 г. Джозеф Пристли выделил тот же газ, пропуская пары спирта через раскалённую медную трубку. Голландский химик Дейман обнаружил, что при действии хлора на этилен образуется маслянистая жидкость, названная впоследствии «маслом голландских алхимиков»: СН2=СН2+Cl2®CH2Cl—CH2Cl (1,2-дихлорэтан).
Благодаря этой интересной особенности этилен долгое время именовали «маслородным газом» (лат. gas olefiant), а его гомологи (алкены) получили название олефины.
Простейшим представителем углеводородов с тройной связью ОС является ацетилен С2Н2. Подобно метану и этилену, ацетилен — родоначальник гомологического ряда алкинов (ацетиленовых углеводородов). Впервые этот газ был выделен в 1836 г. Эдмундом Дэви, двоюродным братом Гемфри Дэви, при разложении водой карбида калия: К2С2+2Н2О=С2Н2+2КОН, полученного при сплавлении металлического калия с углём. Эдмунд Дэви описал свойства одного из продуктов этой реакции, названного им «новым газообразным двууглеродистым водородом»: его растворимость в воде, плотность, горение на воздухе ярким коптящим пламенем, способность взаимодействовать с хлором. В 1855 г. М. Бертло получил ацетилен в разряде электрической дуги между угольными электродами в атмосфере водорода: 2С+Н2®СHºСН.
Углеводороды с двумя двойными связями называют алкадиенами (диеновыми углеводородами). Особенными свойствами обладают диены, в молекулах которых двойные связи разделены одинарной. Это приводит к взаимодействию двух p-связей, образующих единую p-систему молекулы, и перераспределению электронной плотности: в промежутке между кратными связями она оказывается более высокой.
Простейшим примером соединений такого рода является дивинил (бутадиен-1,3). При комнатной температуре это бесцветный газ с характерным резким запахом, легко конденсирующийся в жидкость (tкип = -4,4 °С).