Своему широкому распространению в природе амины — органические соединения, включающие NH2-группу, обязаны белкам: в аминокислотах, входящих в их состав, всегда содержится аминогруппа. Именно она наделяет белковую молекулу свойствами, обеспечивающими функционирование живых организмов (см. статью «Азбука живой материи. Белки»). В природе низшие алифатические амины образуются при гниении белков. Например, запах тухлой рыбы обусловлен триметиламином, а 1,4-диаминобутан (путресцин, от англ. putrescence — «гниение») и 1,5-диаминопентан (кадаверин, от лат. cadaver — «труп») — действующие начала трупного запаха.
Амины были подробно изучены немецким учёным Августом Вильгельмом Гофманом, которого по праву считают основоположником химии аминов. Это направление химической науки в XIX в. развивалось особенно стремительно. Дело в том, что в 1834 г. немецкий химик Фридлиб Фердинанд Рунге (1795—1867) обнаружил в каменноугольной смоле анилин (фениламин) C6H5NH2, который оказался ценным сырьём для синтеза красителей и лекарственных веществ. Производство анилиновых красителей стало интенсивно осваиваться после того, как русский химик Николай Николаевич Зинин открыл в 1842 г. способ восстановления нитросоединений в амины, используя в качестве восстановителя сульфид аммония. В 1845 г. Гофман усовершенствовал этот способ, заменив сульфид аммония более быстродействующим восстановителем — водородом в момент выделения, образующимся в реакциях металлов с кислотами.
Амины легко вступают в реакцию с кислотами с образованием солей алкиламмония. Эту особенность аминов заметил ещё французский химик Шарль Адольф Вюрц (1817—1884), назвав их «летучими органическими основаниями». Так, метиламин, подобно аммиаку, активно взаимодействует с соляной кислотой (донором Н+), превращаясь в катион: CH3NH2+HCl=[CH3NH3]+Cl-. Образующийся хлорид метиламмония представляет собой белое кристаллическое вещество, растворимое в воде и по свойствам похожее на хлорид аммония NH4Cl.
Подобно аммиаку, амины также обратимо реагируют с водой с образованием катионов аммония.
Август Вильгельм Гофман.
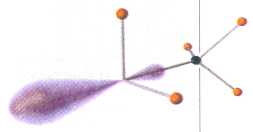
Электронное строение аминов напоминает строение аммиака — их характерной особенностью является наличие неподелённой электронной пары, которая и обусловливает основные свойства этих соединений.
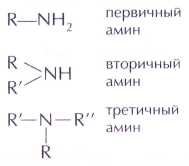
Эту банку с диизопропиламином ((CH3)2CH)2NH хранили неплотно закрытой рядом с соляной кислотой, и на её крышке вскоре выросла шапочка из кристаллов хлорида диизопропиламмония [((CH3)2CH)2NH2]+Cl-.
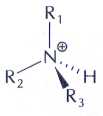
Атом азота в катионе, образующемся при реакции аммиака или аминов с водой, связан, как и в ионе аммония, с четырьмя атомами, расположенными в вершинах тетраэдра. гидроксид-ионов: CH3NH2+Н2О=CH3NH3++ОН-.
При взаимодействии большинства алифатических аминов с водой концентрация гидроксильных ионов возрастает настолько, что помещённый в раствор индикатор показывает щелочную среду.
При алкилировании (введении в органическую молекулу углеводородного радикала) первичных и вторичных аминов атомы водорода при азоте последовательно замещаются на различные группы:
При действии на алкиламмониевую соль щёлочью выделяется свободный амин:
[(CH3)3NH]+Br+КОН=(CH3)3N+KBr+Н2О.
Конечным продуктом алкилирования является соль четвертичного аммониевого основания:
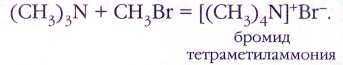
В живом организме четвертичные аммониевые соли играют важнейшую роль в передаче нервных импульсов.
В реакциях аминов с карбоновыми кислотами или их функциональными производными (ангидридами, хлорангидридами) образуются амиды — производные аммиака, в которых при атоме азота находится карбонильная группа .
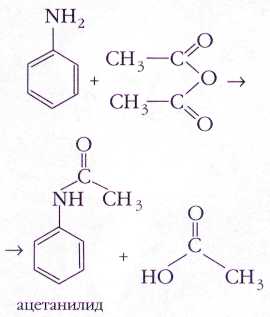
Ацилирование (введение ацильной группы RC(O)) анилина уксусным ангидридом приводит к ацетанилиду, который препятствует сворачиванию крови и поэтому называется антифибрином (от лат. fibra — «волокно»). Его производное -- пара-гидроксиацетанилид используется в медицине в качестве болеутоляющего и жаропонижающего средства парацетамола.
Амидная группа входит в состав таких необходимых для живых организмов соединений, как пептиды, белки, нуклеиновые кислоты (см. статьи «Азбука живой материи. Белки», «Хранитель наследственной информации. ДНК»)

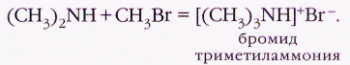
Похожие статьи