Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название — алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
В химии спиртами называют органические вещества, содержащие метанол) СН3ОН образуется при сухой перегонке древесины (отсюда его старое название — древесный спирт). В отличие от этанола, метанол — сильнейший яд, и обращение с ним требует крайней осторожности.
Все спирты — жидкости или твёрдые вещества. Низшие спирты хорошо растворимы в воде, а первые члены ряда — метиловый, этиловый и пропиловый спирты — смешиваются с ней в любом соотношении.
Для спиртов, начиная с пропилового СН3СН2СН2ОН, характерна изомерия. Например, существуют пропиловый и изопропиловый спирт с общей формулой С3Н7ОН, четыре бутиловых С4Н9ОН.
Свойства этих соединений существенно различаются. Так, н-бутиловый и изобутиловый спирты при нагревании окисляются оксидом меди(П) до альдегидов (подобно метанолу и этанолу), а вторбутиловый спирт — до кетона: (СН3)2СНСН2ОН+CuО®(СН3)2СНСНО; СН3СН2СН(ОН)СН3+
+ CuО®СН3СН2СОСН3. Трет-бутиловый спирт в этих условиях не изменяется.
При использовании сильных окислителей (например, раствора КMnО4) спирты окисляются до карбоновых кислот или даже до углекислого газа. При окислении этилового спирта хлором образуется хлораль (трихлоруксусный альдегид) — бесцветная жидкость с резким запахом:
С2Н5ОН+4Сl2®ССl3СНО+5НСl.
Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
Подобно воде, спирты — очень слабые кислоты; они взаимодействуют только с активными металлами с выделением водорода и образованием алкоголятов (в чистом виде — твёрдых веществ белого цвета):
2С2Н5ОН+2Na=2C2H5ONa+H2.
Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
В присутствии концентрированной серной кислоты многие спирты подвергаются дегидратации — теряют воду. При температуре выше 1б0 °С в результате дегидратации этилового спирта образуется этилен, а при более низкой температуре (140 °С ) — диэтиловый (серный) эфир:
2С2Н5ОН®С2Н5—О—С2Н5+Н2О.
Образование легколетучей жидкости с характерным сладковатым запахом («истинного сладкого купоросного масла») при нагревании винного спирта с серной кислотой (отсюда — название «серный эфир») упоминается в трудах многих алхимиков. Парацельс называл эту реакцию «уснащением кислот». Он же предложил использовать смесь диэтилового эфира со спиртом в медицине. В XVIII в. она получила название «капли Гофмана».
Диэтиловый эфир принадлежит к классу простых эфиров. Это бесцветная жидкость, малорастворимая в воде, tкип=34,5 °С. В отличие от спиртов, простые эфиры плохо растворяются в воде и не реагируют с металлическим натрием, поскольку в них нет кислотного атома водорода.
Русский химик Александр Павлович Эльтеков (1846—1894) установил, что спирты, содержащие гидроксильную группу у атома углерода при двойной связи, неустойчивы и изомеризуются в карбонильные соединения (правило Элътекова). Простейший из таких спиртов — виниловый СН2=СН—ОН. Он образуется в реакции
гидратации ацетилена и из-за своей нестойкости очень быстро превращается в ацетальдегид. А вот простые эфиры винилового спирта вполне устойчивы. Винилэтиловый эфир, например, получают в результате реакции этанола с ацетиленом в присутствии катализатора — соли Hg2+:
СHºСН+С2Н5ОН®C2H5—O—CH=CH2.
Класс спиртов включает в себя также циклические соединения. Многие ароматические спирты действительно имеют приятный запах. Например, фенилэтиловый спирт С6Н5СН2СН2ОН (2-фенилэтанол), содержащийся в розовом масле, придаёт ему нежный аромат.
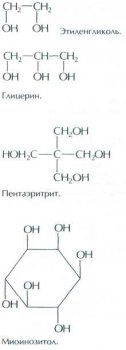
Многоатомные спирты по ряду свойств сходны с одноатомными. Спирты, содержащие две ОН-группы, называются гликолями, три — глицеринами, а четыре — эритритами.
Родоначальник ряда трёхатомных спиртов — глицерин, входящий в виде эфиров в состав жиров. Это бесцветная сиропообразная жидкость, сладковатая на вкус, растворимая в воде. В тканях живых организмов (дрожжах, клетках печени человека) содержится некоторое количество шестиатомного спирта миоинозитола.
Характерной особенностью многоатомных спиртов является их способность взаимодействовать с гидроксидом меди(Н) с образованием
*Простыми эфирами называют вещества, в которых два углеводородных остатка связаны атомом кислорода: R—O—R. темно-синего раствора комплексного соединения меди:
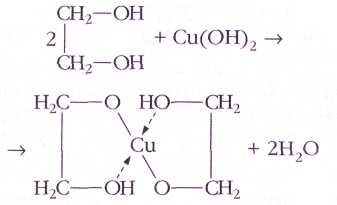
Гидроксильная группа часто входит в состав многих полифункциональных (относящихся одновременно к нескольким классам) соединений, таких, как нуклеотиды, многие гормоны, витамины. Все эти вещества проявляют некоторые свойства спиртов.
Похожие статьи