(XII в.) открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит гамбургскому алхимику-любителю Хеннигу Бранду (около 1630—1730). В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить её из большого количества мочи, предварительно собранной в солдатских казармах. При нагревании этой жидкости Бранду удалось выделить тяжёлое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Ортофосфорная кислота является трёхосновной кислотой, средней силы по первой ступени и слабой по второй и третьей.
Всем этим трём анионам (РО43-, НРО42-, Н2РО4-) соответствуют различные соли — кислые, средние или основные.
При смешении растворов хлорида кальция и ортофосфата натрия (среда сильнощелочная в результате гидролиза соли) образуется осадок основного фосфата кальция — минерал апатит:
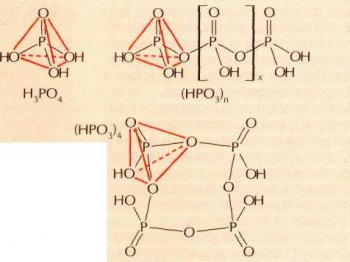
Строение ортофосфорной кислоты и метафосфорных кислот.
Оксид фосфора(IV) и фосфорную кислоту получил и исследовал немецкий химик Андреас Cuгизмунд Маргграф. Оксид фосфора (V) жадно поглощает воду, переходя в метафосфорную кислоту НРО3, — на этом основано его использование в качестве осушителя. Известно несколько метафосфорных кислот с обшей формулой (НРО3)x, где х=4 (тетраметафосфорная кислота), 6 (гексаметафосфорная кислота) или бесконечности (полиметафосфорные кислоты). При кипячении раствора метафосфорных кислот связи между отдельными фосфор-кислородными тетраэдрами разрываются, и метафосфорная кислота переходит в ортофосфорную кислоту H3PO4. В растворе для фосфорных кислот (в противоположность азотной кислоте) проявление окислительных свойств не характерно.
В теле человека массой 70 кг содержится около 780 г фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденозинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г хлеба содержится примерно 200 мг фосфора). Наиболее богаты фосфором рыба (180 мг в 100 г продукта), фасоль (540 мг на 100 г продукта), некоторые виды сыра (до 600 мг на 100 г продукта). Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальция: оптимальное соотношение этих элементов в пище составляет 1,5:1. Избыток богатой фосфором пиши приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO2, КСlО3, ВаСrO4) и восстановители (S, Sb2S3). При трении о зажигательную поверхность смесь, нанесённая на спичку, воспламеняется. Первые фосфорные спички — с головкой из белого фосфора — были созданы лишь в 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX в.
В старину для добычи селитры использовали солевые наросты, покрывавшие сырые стены каменных построек. В начале лета их соскребали, добавляли поташ и варили, а затем кристаллизовали. Из смеси нитратов аммония и кальция, содержащихся в этих наростах, образовывался нитрат калия — калийная селитра:
2NH4NO3+К2СО3®t°2KNO3+2NH3+СО2+Н2О
Ca(NO3)2+К2СО3 ®t°2KNO3+СаСО3.
Начиная с XV в. селитру стали получать из «селитряниц» — специальных ям, заполненных органическими отходами. Содержимое селитряниц, в которых образовывался нитрат аммония, подвергали варке с поташом.
Владимир Иванович Даль в «Толковом словаре живого великорусского языка» (1882 г.) даёт следующие толкования слов «селитра», «поташ» и связанных с ними понятий:
С азотной кислотой взаимодействуют практически все металлы разной химической активности (исключение составляют благородные металлы — платина, золото, рутений, родий, осмий и иридий). В отличие от других кислот, в реакциях HNO3 с металлами водород, как правило, не выделяется. Продуктами восстановления НNО3 являются оксиды азота в различных степенях окисления, свободный азот или ион аммония — в зависимости от активности металла. Состав этих продуктов определяется концентрацией кислоты (чем она выше, тем в меньшей степени протекает восстановление) и природой металла (чем активнее металл, тем полнее протекает восстановление кислоты). Следовательно, наиболее полного восстановления (до иона аммония) можно добиться, используя очень разбавленную, 1—3-процентную, азотную кислоту.
Некоторые металлы (железо, хром, алюминий) при комнатной температуре с концентрированной азотной кислотой не взаимодействуют: они пассивируются, так как на их поверхности образуется тонкая защитная плёнка соли. Даже барий, активно реагирующий с водой, может спокойно лежать на дне стакана с концентрированной азотной кислотой, поскольку покрывается коркой нитрата бария, практически нерастворимого в этой кислоте.
Глядя на литровые банки с бесцветной, ничем не примечательной жидкостью, трудно представить, какая разрушительная сила таится за стеклянными стенками. Азотная кислота — настолько сильный окислитель, что некоторые органические вещества (в частности, скипидар) при соприкосновении с ней воспламеняются.
Безводная азотная кислота HNO3 — бесцветная летучая жидкость (tкип=83 °С; из-за летучести безводную кислоту называют «дымящей») с резким запахом. В лаборатории её получают по методу Глаубера — действием на селитру концентрированной серной кислоты. При нагревании азотная кислота переходит в пар, который конденсируется в приёмнике, охлаждаемом льдом.
В 30-х гг. XX в. химиками были получены ортонитраты — соли неизвестной в свободном виде ортоазотной кислоты H3NO4 (аналога ортофосфорной кислоты Н3РО4). Ортонитрат натрия образуется при сплавлении в течение нескольких дней нитрата и оксида натрия:
NaNO3+Na2O ®300°C Na3NO4.
Вещество представляет собой бесцветные кристаллы, но, в отличие от устойчивых ортофосфатов, легко разлагается на нитрат и гидроксид натрия в присутствии влаги воздуха.
Водный раствор аммиака считается слабым основанием, поскольку в нём гидроксид-ионы содержатся в небольшом количестве (по сравнению с водными растворами сильных оснований — гидроксида натрия или гидроксида калия, которые полностью распадаются на ионы). Раньше низкую концентрацию гидроксид-ионов в водных растворах аммиака объясняли тем, что при взаимодействии аммиака с водой образуется гидроксид аммония NH4OH, который и проявляет основные свойства:
NH3•Н2О=[NH4OH]« NH4++ОН-.
Но, как показали исследования, такого соединения не существует ни в водных растворах, ни в твёрдом виде. В водном растворе аммиак присутствует в основном в виде гидрата NH3•nН2О, в незначительной степени распавшегося на ионы. Однако при низких температурах аммиак образует твёрдый гидрат NH3•Н2О с tпл=-79 °С (такого же состава, что и гипотетическое основание NH4OH), в структуре которого, безусловно, не содержится никаких ионов.
Кроме аммиака известно ещё несколько соединений азота с водородом. Одно из них — гидразин N2H4 — представляет собой бесцветную жидкость с запахом аммиака (tпл=2 °С, tкип=114 °С). Молекула гидразина напоминает молекулу пероксида водорода, так как состоит из двух одинаковых фрагментов, соединённых одинарной связью элемент — элемент (в данном случае N—N). Как и аммиак, гидразин является сильным восстановителем, а также проявляет свойства основания: известны соли гидразония, например [N2H5]+Cl-. В отличие от аммиака, гидразин легко сгорает на воздухе с выделением большого количества тепла. На этом основано использование гидразина (а также его органических производных, в частности 1,1 -диметилгидразина — гептила (CH3)2N—NH2) в качестве ракетного топлива. Так, топливом для лунного модуля «Аполлон-11» служила смесь равных масс N2O4 (окислитель) и 1,1-диметилгидразина (восстановитель).
Особые химические свойства аммиака — донорные свойства — обусловлены наличием неподелённой электронной пары. Эту пару частица-донор использует при образовании ковалентной связи с частицей, имеющей вакантную орбиталь (акцептором). Так, NH3 легко вступает в реакцию с кислотами. Летучие кислоты (например, соляная или азотная), контактируя с аммиаком, дают густой белый дым, который состоит из мельчайших кристаллов аммонийной соли. Катион аммония NH4+ образуется по донорно-акиепторному механизму при взаимодействии свободной электронной пары молекулы аммиака с вакантной s-орбиталыо иона водорода.