Особые химические свойства аммиака — донорные свойства — обусловлены наличием неподелённой электронной пары. Эту пару частица-донор использует при образовании ковалентной связи с частицей, имеющей вакантную орбиталь (акцептором). Так, NH3 легко вступает в реакцию с кислотами. Летучие кислоты (например, соляная или азотная), контактируя с аммиаком, дают густой белый дым, который состоит из мельчайших кристаллов аммонийной соли. Катион аммония NH4+ образуется по донорно-акиепторному механизму при взаимодействии свободной электронной пары молекулы аммиака с вакантной s-орбиталыо иона водорода.
Аммоний является однозарядным катионом, сходным с катионами щелочных металлов (К+). Соли аммония, как и соли щелочных металлов, хорошо растворимы. Отличительные особенности аммонийных солей — их способность разлагаться под действием щёлочи с выделением аммиака, а также их термическая неустойчивость. Если соль образована летучей кислотой (например, соляной), то при нагревании такая соль распадается на аммиак и пары кислоты,
которые, взаимодействуя между собой, вновь образуют на холодных стенках пробирки исходное соединение:

Если анион аммонийной соли проявляет окислительные свойства, то при нагревании вещество «окисляет само себя» — происходит внутримолекулярная окислительно-восстановительная реакция:
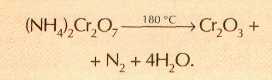
К насыпанному в фарфоровую чашечку дихромату аммония прикоснёмся стеклянной палочкой, раскалённой в пламени горелки. Реакция сопровождается выделением газа, мерцанием пламени и разбрасыванием образующейся зелёной пористой массы оксида хрома(III). Всё это напоминает кратер действующего вулкана. Проводя опыт, необходимо проявлять осторожность, так как мельчайшие частицы оксида хрома обладают канцерогенным действием, т. е. могут вызвать рак.

Похожие статьи