В 1832 г. Юстус Либих заинтересовался химическими свойствами «горькоминдального масла» (бензальдегида, С6Н5СНО). Это было сравнительно доступное органическое вещество, а в то время химики изучали только такие соединения, которые легко можно выделить из природных источников. При действии галогенов на миндальное масло Либих получил бензоилхлорид С6Н5СОСl и бензоилбромид С6Н5СОВr. Реакция любого из этих соединений с водой давала хорошо известную бензойную кислоту С6Н5СО—ОН: С6Н5СОВr+Н2О®C6H5OOH+НВr.
Либих выделил и другие производные бензальдегида. И во всех превращениях сохранялась неизменной группировка атомов состава С7Н5О. Эту группировку — радикал бензойной кислоты Либих назвал бензоилом.
Открыть бензол, как это нередко бывает, помог случай. Начиная с 10-х гг. XIX в. в Лондоне для освещения улиц в фонарях стали использовать светильный газ. Его получали сухой перегонкой каменного угля и хранили под давлением в герметических ёмкостях. При этом в сосудах накапливалась неизвестная жидкость, особенно обильно — в холодную погоду. Фарадей начал изучать её и 18 мая 1825 г. выделил соединение, которое кипело при 80 °С. Учёный очистил его вымораживанием: при температуре 7 °С вещество превращалось в белую кристаллическую массу, тогда как все примеси оставались жидкими. К началу июня Фарадей провёл элементный анализ нового соединения и определил, что оно содержит углерод и водород в соотношении 11,4:1. Полученные Фарадеем данные практически соответствуют установленным современными учёными характеристикам бензола: он кипит при 80,1 °С, затвердевает при 5,53 °С и имеет соотношение С:Н=11,9:1.
Пользуясь относительными атомными массами Дальтона (Н=1, С=6), Фарадей приписал полученному им соединению неверную формулу С2Н, назвав его «bicarburet of hydrogen», т. е. «двууглеродистым водородом». Однако вскоре шведский химик Якоб Берцелиус опубликовал уточнённую таблицу атомных масс элементов (Н=1, С=12,26), в соответствии с которой открытый Фарадеем углеводород должен был иметь простейшую формулу СН. Истинную формулу этого соединения С6Н6 установили уже после того, как удалось определить его молекулярную массу.
Майкл Фарадей.
Среди 18 миллионов известных на сегодняшний день органических соединений немного найдётся таких, которые повлияли бы на развитие органической химии сильнее, чем бензол. Полученный впервые в 1825 г., он более века был постоянной головной болью химиков. Сначала не могли понять, как выглядит молекула бензола. Потом десятилетиями пытались объяснить его уникальные свойства.
Первооткрыватели циклоалканов сразу отметили разницу в химическом поведении малых и средних углеродных циклов. Отталкиваясь от этих различий в свойствах и пытаясь их обосновать теоретически, А. Байер создал учение о внутренних напряжениях в циклических молекулах.
При обычных условиях (t=20 °С, р=1 атм) малые циклоалканы существуют в виде газов, средние — легколетучих жидкостей, а большие — как вязкие нелетучие масла. Будучи веществами с практически неполярными молекулами, все они не растворимы в воде.
Наиболее напряжённый из циклоалканов — циклопропан: из-за отталкивания электронных облаков его буквально распирает изнутри. Он раскрывается с разрывом углерод-углеродных связей в цикле при любом химическом воздействии. Вещества, которые реагируют с циклопропаном, вступают с ним в реакции присоединения, сопровождающиеся раскрытием его углеродного цикла. Водород гидрирует самый младший алицикл уже при температуре 80 °С, превращая его в линейный пропан:
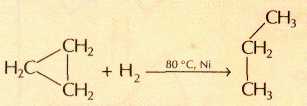
Вторая половина XIX столетия для молодой органической химии оказалась периодом, с одной стороны, становления её теоретических основ, а с другой — совершенствования экспериментального мастерства исследователей. Именно тогда родилось новое направление в этой области химического знания — органический синтез, основной задачей которого стало изучение синтетических методов получения различных органических веществ. Именно благодаря усилиям химиков-синтетиков конца XIX — первой половины XX столетия были созданы классические общие методы синтеза простых алициклов и их различных производных.
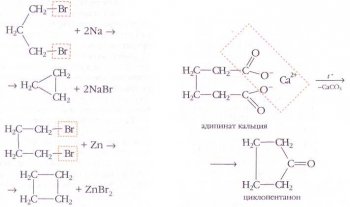
Одним из универсальных лабораторных способов получения циклоалканов и их гомологов является действие металлического натрия или цинковой пыли в неполярном растворителе на дибромалканы, не содержащие атомы галогена у соседних атомов углерода:
К простейшим терпенам циклического строения относится лимонен С10Н16 — он входит в состав лимонного и мятного масел. Однако главной составной частью мятного масла является спирт ментол С10Н19ОН — производное углеводорода ментана (1-метил-4-изопропилциклогексана С10Н20). Ментол — кристаллическое вещество с запахом мяты и приятным холодящим вкусом. В качестве ароматизатора его добавляют в зубные пасты, жевательные резинки. Кроме того, это действующее начало некоторых лекарственных препаратов, например валидола — раствора ментола в ментиловом эфире изовалериановой кислоты. Это лекарство снимает приступы стенокардии, расширяя кровеносные сосуды.
Как известно, углерод — основной элемент любого органического вещества. В отличие от подавляющего большинства элементов периодической системы, он обладает замечательной особенностью — способностью образовывать устойчивые циклические молекулы.
Среди соединений из двух элементов — углерода и водорода (углеводородов) — есть обширный класс веществ, циклические молекулы которых содержат только одинарные углерод-углеродные связи или одиночные кратные связи. Такие углеводороды и их многочисленные производные называются алициклическими (от греч. «алифатос» — «жир» и «циклос» — «круг»).
Сбор терпентина (скипидара).
Миниатюра из рукописи «Книги о простейших лечебных средствах»
Платтеария Маттеуса. Середина XV в. Франция.
С незапамятных времён человек пользуется дарами природы — разнообразными полезными веществами. Ценнейшие амбра и мускус, лимонное и мятное масло издавна входили в состав восточных благовоний. Лекарствами служили камфора, получаемая из листьев камфорного лавра, а также терпентиновое масло — из смолы хвойных деревьев...
Несмотря на известные до тонкостей способы выделения и применения подобных подарков природы, их состав и строение долго оставались неизвестными — ведь химии до становления как науки пришлось проделать долгий путь.
Состав и строение давно известных природных веществ были определены лишь в XIX в. И оказалось, что многие душистые вещества растительного и животного происхождения, лекарственные средства имеют в своём составе углеродные циклы.
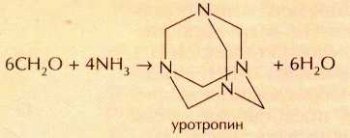
В 1860 г. А. М. Бутлеров обнаружил, что взаимодействие водных растворов аммиака и формальдегида приводит к образованию белого кристаллического вещества — уротропина (гексаметилентетрамина C6H12N4):
Атомы углерода и азота в молекуле уротропина расположены в пространстве так же, как атомы углерода в элементарной ячейке алмаза.
Это вещество используется как «сухое горючее» (так называемый твёрдый спирт), а также входит в состав некоторых лекарств.
Своему широкому распространению в природе амины — органические соединения, включающие NH2-группу, обязаны белкам: в аминокислотах, входящих в их состав, всегда содержится аминогруппа. Именно она наделяет белковую молекулу свойствами, обеспечивающими функционирование живых организмов (см. статью «Азбука живой материи. Белки»). В природе низшие алифатические амины образуются при гниении белков. Например, запах тухлой рыбы обусловлен триметиламином, а 1,4-диаминобутан (путресцин, от англ. putrescence — «гниение») и 1,5-диаминопентан (кадаверин, от лат. cadaver — «труп») — действующие начала трупного запаха.
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3—15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию — раствор с концентрацией уже 70—80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH3COOHNa+H2SO4 (конц.)= CH3COOH+NaHSO4.
В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»). Впоследствии энтомологи — специалисты по насекомым (от греч. «энтомон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьев в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает.