Кремний и углерод — близкие родственники. Многие соединения кремния имеют углеродные аналоги, а сам он, как и углерод, может образовывать цепочки атомов. Неслучайно поэтому в научной фантастике встречаются рассуждения на тему «кремниевых» миров — биологических систем, в которых роль углерода в построении молекул играет кремний.
Однако вероятность существования кремниевых организмов даже в дальнем космосе крайне мала. Пока не удалось построить кремниевый аналог хоть сколько-нибудь сложной биологический молекулы. К концу XX в. получены соединения, содержащие кремниевые цепочки длиной до пяти атомов. И если гексаметилдисилан (CH3)3Si—Si(CH3).. достаточно устойчив, то уже производное трисилана (CH3)3Si—Si(CH3)2—Si(CH3)3легко окисляется на воздухе. А соединения, содержащие цепочки из четырёх или пяти атомов кремния, на воздухе самовоспламеняются. Синтезирован только один аналог алкенов — тетрамезитилдисилен; в нём атомы кремния со всех сторон «прикрыты» триметилбензольными (мезитиленовыми) кольцами.
Кремниевые аналоги алкинов и более сложных органических молекул получить пока не удалось.
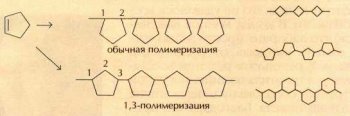
Во-вторых, подобные полимеры обладают исключительной термостойкостью. Полициклопентен плавится при 395 °С, полициклобутен — при 485 °С, а полициклогексен — при 600 °С, что сопоставимо с температурой размягчения оконного стекла.
Не много можно найти органических соединений, которые бы не разлагались при такой температуре.
Долгое время алюминийорганические соединения, впервые полученные в 1865 г. Дж. Бактоном и У. Одлингом при нагревании алюминия с диалкилртутью, не представляли хоть сколько-нибудь заметного практического интереса. Ситуация коренным образом изменилась в начале 50-х гг. XX в., когда были открыты алюминийорганические катализаторы полимеризации олефинов.
Достаточно давно было известно, что триэтилалюминий реагирует с этиленом. При этом молекула этилена внедряется в связь алюминий-утлерод:
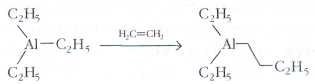
Однако для получения полимера такая реакция не годится — идёт медленно, да и цепочки получаются коротенькие.
С другой стороны, ртутьорганические соединения вступают в реакции, необычные и интересные с точки зрения органической химии. Если в молекуле органического вещества есть связь С=С, то атом ртути легко образует с ней комплекс. Это значительно облегчает различные реакции присоединения к двойной углерод-углеродной связи. Данное свойство было использовано русским химиком Михаилом Григорьевичем Кучеровым (1850—1911) для присоединения воды к ацетиленам.
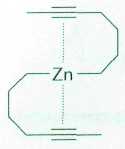
Реальная химия элементоорганических соединений началась с цинкорганических соединений, которые оказались весьма полезными, например для надёжного, достаточно хорошо воспроизводимого и предсказуемого метода синтеза спиртов. Так, при работе над теорией химического строения Бутлерову потребовалось соединение, содержащее четвертичный атом углерода. В то время подобные соединения не были изучены. Взаимодействие ацетона с диметилцинком привело к желаемому третичному бутанолу (СН3)3СОН. Правда, впоследствии оказалось, что такие реакции проходят с большими выходами, если цинк заменить на магний.
Пример цинкорганического соединения.
Виктор Гриньяр писал о магнийорганических соединениях, что они в руках химика подобны скрипке в руках умелого музыканта. Действительно, использование магнийорганических соединений открывает практически неисчерпаемые возможности органического синтеза. Реактивы Гриньяра взаимодействуют с альдегидами, кетонами, сложными эфирами, нитрилами, азосоединениями и т. д. Спектр получаемых продуктов, безусловно, столь же разнообразен (см. схему).
С реактивами Гриньяра также взаимодействуют и многие неорганические соединения, содержащие кратную связь, — диоксиды углерода, серы, селена, теллура.
В 1855 г. при попытке выделить органический радикал бутил в реакции бутилбромида с натрием Шарль Вюрц вместо бутила получил продукт его «сдваивания» — октан: С4Н9Br ®«С4Н9»+NaBr; 2«С4Н9»®С8Н18.
По одной из современных версий, механизм этой реакции включает в себя образование натрийорганического соединения C4H9Na с его последующим взаимодействием с С4Н9Br.
С 60-х гг. XIX в. благодаря усилиям Франкленда начала стремительно развиваться химия цинкорганических соединений. А в 1899 г. учёный определил условия, при которых в реакции участвуют магнийорганические соединения. Однако все попытки выделить их заканчивались неудачей.
Главная проблема заключалась в том, что их считали подобными цинкорганическим, которые были достаточно хорошо изучены, и пытались получить аналогичными методами. Однако цинкорганические соединения — летучие жидкости, а магнийорганические — твёрдые солеподобные вещества, следовательно, для их получения нужен другой подход. И такой подход был найден уже в 1900 г.,
Элементоорганическая химия строит мост между органической и неорганической химией. По мере развития и роста элементоорганической химии этот мост становится массивом, смешивающим воедино оба материка химии.
А. Н. Несмеянов
В 1823 г. датский фармацевт Вильям Кристофер Цейзе (1789—1847) при кипячении платинохлороводородной кислоты в этиловом спирте впервые выделил комплекс металла с этиленом - K[PtCl3(CH2=CH2)]•Н2О. Результат был столь необычен, что многие химики вообще не поверили в существование подобных соединений, ведь соль Цейзе явно не принадлежала ни к одному из известных в то время классов веществ. Потому-то Юстус Либих и считал результаты Цейзе ошибкой эксперимента. Однако в 1849 г. английский химик Эдуард Франкленд (1825—1899) случайно открыл ещё одно соединение этого типа. Приступая к опытам, учёный рассчитывал получить свободный этил — по аналогии с реакциями активных металлов с солями:
Чувствительность языка неодинакова к различным вкусам. Первое место занимают вещества горькие. Это именно тот случай, когда ложка дёгтя портит бочку мёда. Действительно, вкус хинина или стрихнина, например, отчётливо ощущается, даже если развести их в воде в соотношении 1 : 100 000 и более (примерно чайная ложка вещества в 500 кг воды!).
Впервые хинин был выделен из коры хинного дерева, произрастающего в Южной Америке. Это белое кристаллическое вещество применяется как одно из самых эффективных средств против малярии. В очень малых количествах хинин добавляют к горчащим напиткам типа тоника, хорошо утоляющим жажду. Обнаружить это вещество можно не только по вкусу, но и по яркому нежно-голубому свечению под лучами ультрафиолетовой лампы.
Порошок нестерпимо горького хинина фармацевты обычно заключают в капсулы из желатина. Человек глотает капсулу, не ощущая никакого вкуса; потом в пищеварительном тракте желатин растворяется, и лекарство попадает в кровь. Однако описаны случаи, когда после приёма хинина в капсулах, исключающих непосредственный контакт лекарства с языком, люди жаловались на горький вкус во рту. Вероятно, попав в кровь, хинин возбуждает вкусовые нервы «изнутри языка».
Хинин относится к классу алкалоидов — так называют природные соединения, выделяемые обычно из растений и содержащие в молекуле один или несколько атомов азота. Вообще среди алкалоидов много горьких и очень горьких веществ, например кофеин, никотин, стрихнин. Известно более тысячи алкалоидов, и многие из них не только горькие, но и ядовитые (стрихнин, кураре). Возможно, ощущение их отвратительного вкуса выработалось у человека в процессе эволюции как защитная реакция организма против отравления.
Всем известно, что лучший способ снять усталость после рабочего дня — выпить одну-две чашки крепкого чая или кофе.
В листьях чая и зёрнах кофе содержится от одного до трёх процентов алкалоида кофеина, являющегося производным пурина. При заваривании чая или приготовлении кофе кофеин переходит в раствор. В растениях кофеин образуется по сложной цепочке превращений из пуриновых оснований — аденина и гуанина. В промышленности его выделяют из отходов чайного производства, из несортовых кофейных зёрен, а также получают синтетически.
Кофеин C8H10N4O2 представляет собой бесцветные горькие на вкус шелковистые игольчатые кристаллы (tпл=235 °С), легко растворимые в горячей воде и хлороформе.
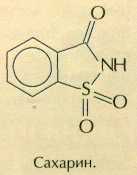
Сахарин — самый давний и наиболее известный пищевой заменитель сахара. Чтобы почувствовать его вкус, достаточно всыпать в железнодорожную цистерну с водой всего лишь ложку этого вещества! Впервые сахарин синтезировали в 1878 г. американские химики Аира Ремсен и Константин Фальберг. А случилось это так. В лаборатории профессора Ремсена работал молодой эмигрант из России Фальберг. Он занимался синтезом некоторых производных толуолсульфамида. Как-то Фальберг сел обедать, не вымыв как следует руки, и почувствовал, что пища подозрительно сладковата. Придя обратно в лабораторию, он начал проверять на вкус все реагенты, с которыми работал. Один из промежуточных продуктов синтеза оказался очень сладким. Вещество назвали сахарином. По своему строению это гетероциклическое соединение — имид орто-сульфобензойной кислоты.
Сахарин не усваивается организмом и в небольших дозах безвреден, однако по вкусу отличается от сахара, так как слегка горчит. Кстати сказать, до синтеза сахарина считалось, что сладкими могут быть только природные соединения, поэтому никому не приходило в голову специально пытаться синтезировать такие вещества в лаборатории.
В 1884 г. другой американский химик, Дж. Берлинерблау, тоже случайно получил ещё одно сладкое вещество — 4-этокси-фенилмоче-вину С2Н5О—C6H4—NH—CO—NH2. Новое соединение было названо дульцином (от лат. dulcis — «сладкий»). Оно оказалось в 200 раз слаще сахара и в течение полувека применялось как подсластитель, пока не было доказано его вредное воздействие на здоровье человека.
В мире органических молекул случаются необычные перестановки атомов, которые практически не изменяют «внешнего» вида молекулы, но приводят к существенным различиям в химических свойствах веществ.
Таковы, например, бензол и его структурный аналог — шестиатомный азотсодержащий гетероцикл пиридин.
Замена одного фрагмента — СН= в бензольном ядре на трёхвалентный атом азота не нарушает ароматичности цикла, так как число p-электронов в общем электронном облаке циклической молекулы при этом не уменьшается. Оно по-прежнему равно 6, и молекула пиридина соответствует «ароматическому» критерию Хюккеля.
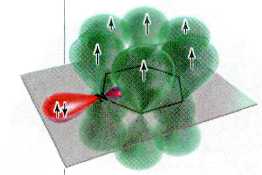
Строение p-системы молекулы пиридина.