Пастер неслучайно упорствовал, не желая сводить брожение к обычному катализу. Дело в том, что ферменты сильно отличаются от небиологических катализаторов.
Во-первых, они чувствительны к температуре, как живые существа. Наиболее распространённый температурный режим промышленных катализаторов — от 200 до 500 °С, а молекулы некоторых ферментов повреждаются уже при 40 °С. При 70 °С большинство ферментов полностью теряют каталитические свойства.
Во-вторых, ферменты чрезвычайно чувствительны к кислотности среды. Каждый фермент работает только в узком интервале рН. Пепсин желудочного сока действует при рН 2—3. Кислая среда обеспечивается соляной кислотой — основным компонентом желудочного сока. Оптимальное значение рН большинства внутриклеточных ферментов — около 7. Это — нейтральная среда, которая обеспечивается кровью. В крови здорового человека рН не отличается от среднего значения 7,4 более чем на 0,2. При рН крови ниже 7,0 или выше 7,8 наступает смерть из-за нарушения деятельности ферментов.
В-третьих, ферменты обладают огромной каталитической активностью: они способны ускорять реакции в 1014—1015 (миллион миллиардов) раз (а многие ферментативные реакции в отсутствие ферментов просто не идут). Возможности обычных катализаторов гораздо скромнее. Например, 1 моль фермента алкогольдегидрогеназы за секунду при комнатной температуре способен превратить в уксусный альдегид 720 моль этилового спирта, в то время как 1 моль медного катализатора при 200 °С справляется лишь с 0,1—1 моль спирта. Правда, 1 моль меди весит 64 г, а 1 моль алкогольдегидрогеназы — примерно 84 кг. Но ведь реакция идёт между частицами, а не между килограммами.
С проявлениями деятельности ферментов мы сталкиваемся на каждом шагу. Разрезанное яблоко темнеет на воздухе, оттого что фермент полифенолоксидаза ускоряет окисление находящихся в клетках плода полифенолов — органических веществ, содержащих соединённые с бензольным кольцом гидроксильные группы. Когда ранку заливают перекисью (пероксидом) водорода Н2О2, перекись «вскипает» — бурно разлагается на воду и кислород под влиянием фермента каталазы, находящегося в крови. Каталаза нужна организму для уничтожения пероксида водорода, который образуется в процессе клеточного дыхания.
В пищеварительных соках содержатся десятки ферментов: липазы, разлагающие жиры на глицерин и органические кислоты; протеазы, разрушающие белки, и др. По мере того как пища проходит по желудочно-кишечному тракту, одни ферменты дробят сложные молекулы на мелкие кусочки, другие помещают эти «кирпичики» на клеточные «склады сырья», третьи строят из них вещества, необходимые организму.
Очень важную роль играют ферменты, называемые фосфатазами: они отвечают за гидролиз (т. е. расщепление с участием воды) сложных эфиров фосфорной кислоты. С помощью этих ферментов организм использует энергию, заключённую в углеводах.
Мы обычно не задумываемся над тем, что вся живая природа существует лишь благодаря ферментативному катализу. Электрические разряды и облучение могут вызвать синтез сложных органических молекул, в том числе полимеров, из смеси метана, аммиака, углекислого газа и воды, но не в состоянии «вдохнуть» в них жизнь.
На сегодняшний день известно свыше 2 тыс. ферментов, а сколько ещё неизвестных... Большинство названий ферментов, как это легко заметить, оканчивается на «аза» — так уж учёные договорились их именовать. А вначале обычно ставят название вещества, на которое действует фермент. Исключения составляют только самые «старые» ферменты, открытые ещё до этой договорённости.
В детстве многих удивляют и забавляют метаморфозы с дрожжевым тестом. Коричневую массу — дрожжи разводят молоком, «подкармливают» сахаром, замешивают с мукой и, заботливо укрыв полотенцем, ставят в тёплое место, а там... Прислушаешься: время от времени будто лопаются пузырьки. Теста становится больше... Оно вылезает из миски!
По «стажу» использования человеком брожение сравнимо разве что с горением древесины. Поэтому неудивительно, что издавна оно привлекало внимание пытливых умов. Пока наши (пра-)nбабки отгоняли наших малолетних (пра-)n-1 дедов от кадушек с тестом, главы семей задумывались над тайной превращения виноградного сусла (ячменного экстракта, табуретки и т. д.) в вино (пиво, эликсир жизни). И те немногие, кто были грамотны, плоды своих размышлений доверяли бумаге.
В трактате знаменитого европейского алхимика Василия Валентина (XV в.) брожение описывается как результат действия некоего духа,...В живых растениях и животных происходят тысячи каталитических процессов между тканями и жидкостями, которые вызывают образование множества разнообразных химических соединений...
Эдуард Бухнер
«Отцами» витамина С можно считать выдающихся английских химиков Эдмунда Ленгли Херста (1898—1975) и Уильяма Н. Хеуорса (1883—1950), которые выделили его в чистом виде и установили его графическую формулу, определив её как g-лактон 2,3-дегидро-L-гулоновой кислоты.
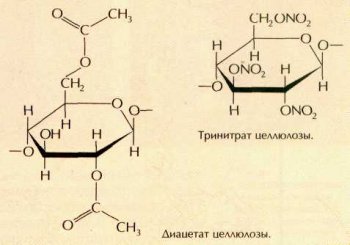
Подобно другим веществам, содержащим гидроксильные группы, целлюлоза вступает в реакцию этерификации с органическими и неорганическими кислотами с образованием сложных эфиров. При этом связи между отдельными фрагментами соединения не разрываются, и возникает полимер, включающий сложно-эфирные группы —COOR—. При взаимодействии целлюлозы с уксусной кислотой или её производными (например, уксусным ангидридом) образуются ацетаты целлюлозы, у которых в каждом звене макромолекулы на эфирные остатки замещены одна, две или три гидроксильные группы.
Ацетаты целлюлозы используются в производстве синтетических волокон (ацетатного волокна).
При нитровании целлюлозы смесью дымящей азотной и концентрированной серной кислот образуется тринитрат целлюлозы, который применяют для приготовления бездымного пороха (пироксилина).
Динитрат целлюлозы служит основным компонентом целлулоида — пластмассы, из которой делают некоторые типы искусственных стёкол.
Бумага (от персидск. «бомбака» — «хлопок») представляет собой материал, состоящий из тонко переплетённых между собой волокон целлюлозы. Отдельные волокна связаны друг с другом посредством водородных связей, которые возникают между гидроксильными группами.
Бумага была изобретена в конце II в. до н. э. в Китае, где её получали из волокон хлопка и бамбука. В VIII в. н. э. секрет изготовления бумаги стал известен арабам, а в IX в. его переняли византийцы.
В Средние века для изготовления бумаги использовали хлопок, пеньку, а также старое тряпьё — хлопковые и льняные ткани. На специальных мельницах их превращали в порошок, который размешивали в воде для получения густой однородной массы. Лишь в XVIII в. было обнаружено, что удобным исходным веществом для производства бумаги может служить древесина. А первые заводы по переработке древесины в целлюлозу появились только в XIX столетии.
Сахар, который вы кладёте в чашку чая или кофе, скорее всего, из сахарной свёклы. Но он мог быть выработан и из сладкого сока других растений. Во многих странах этот продукт получают из сахарного тростника. Хотя с химической точки зрения свекловичный сахар и тростниковый — одно и то же вещество, у них всё же есть отличия. Обнаружить их можно лишь с помощью чувствительного прибора, позволяющего определять соотношение изотопов углерода в образце. В природе углерод встречается в виде двух стабильных изотопов — 12С и 13С, содержание которых, соответственно, 98,892 и 1,108%.
Различие в массах изотопов углерода достаточно велико — около 8 %, и это сказывается на скоростях некоторых химических реакций, идущих в живых организмах. Например, при фотосинтезе растения, поглощая из воздуха углекислый газ, отдают предпочтение более лёгкому изотопу 12С, поэтому во всех живых организмах и продуктах их разложения (угле, торфе, нефти) содержание тяжёлого изотопа 13С немного понижено, тогда как в углекислом газе и карбонатах морского происхождения (известняк из раковин) — повышено.
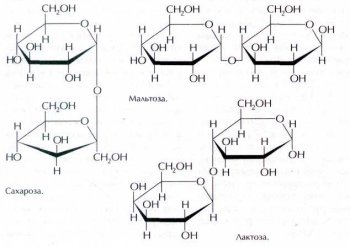
Сахароза (свекольный или тростниковый сахар) С12Н22О11 представляет собой дисахарид, образованный из остатков a-глюкозы и b-фруктозы (в форме полуацеталей), связанных друг с другом. Однако в отличие от этих моносахаридов сахароза не проявляет в растворе восстановительных свойств — не восстанавливает оксид серебра и гидроксид меди (II). В кислой среде сахароза гидролизуется — разлагается водой на глюкозу и фруктозу. Вот самый простой пример: сладкий чай кажется ещё более сладким, если положить в него ломтик лимона, хотя, конечно, и кислым одновременно. Это происходит благодаря присутствию лимонной кислоты, которая ускоряет распад сахарозы на глюкозу и фруктозу.
При внесении сахарозы в раствор медного купороса в присутствии щёлочи образуется ярко-синий сахарат меди — вещество, в котором атомы металла связаны с гидроксильными группами углевода.
Молекулы одного из изомеров сахарозы — мальтозы (солодового сахара) состоят из двух остатков глюкозы. Этот дисахарид образуется в результате ферментативного гидролиза крахмала. В молоке многих млекопитающих содержится другой дисахарид, изомерный сахарозе, — лактоза (молочный сахар). По интенсивности сладкого вкуса лактоза значительно (в три раза) уступает сахарозе.
Хорошо известно, что неспелые яблоки, груши, сливы и другие плоды жёсткие и кислые на вкус. Созревая, они постепенно становятся мягче и слаще. Отчего же это происходит?
Кислый вкус плода объясняется тем, что в его состав входят органические кислоты — яблочная, винная и лимонная. По мере созревания концентрация этих веществ понижается: они расходуются в процессе дыхания растения, окисляясь до углекислого газа и выделяя энергию, необходимую для жизнедеятельности плода. Фрукты становятся слаще и за счёт того, что в них увеличивается содержание глюкозы, образующейся при распаде (гидролизе) крахмала.
В клетках плодов много пектиновых веществ — высокомолекулярных соединений, построенных из остатков галактуроновой кислоты (производного галактозы) или её эфиров.
По мере созревания (а также при хранении) под действием ферментов связи между отдельными молекулами галактуроновой кислоты разрываются, пектиновые вещества переходят в водорастворимую форму — и плод становится более рыхлым и мягким. Сходные процессы протекают и при варке овощей и фруктов.
Пектиновые вещества легко образуют студенистые растворы (гели), особенно при нагревании в присутствии углеводов, например, когда варят варенье, готовят джем и мармелад. При этом пектиновые вещества из фруктов переходят в раствор, который постепенно загустевает. В получившемся геле молекулы пектина образуют пространственную трёхмерную сетку. Её пустоты заполняет вода с растворёнными в ней веществами (сахарами, минеральными солями). В кондитерской промышленности для производства джемов используют пектины, специально выделенные из лимонных корок или яблок.

У спелого плода и окраска ярче, чем у незрелого. Это связано с тем, что в процессе созревания активность некоторых ферментов, ответственных за синтез красителей (каротинов, антоцианов), повышается.
Из сладких веществ, несомненно, самое известное — обыкновенный пищевой сахар (сахароза). В наши дни две трети его мирового производства (более 60 млн. тонн) — это тростниковый сахар, тогда как на долю продукта из сахарной свёклы приходится примерно 35 млн. тонн. Рафинированная (99,9-процентная) сахароза — одно из самых многотоннажных чистых органических соединений, выпускаемых промышленностью. А головой урожай сахарного тростника — около 1 млрд. тонн (!) — значительно превышает объём заготовок любой другой сельскохозяйственной культуры.
Сахарозу используют как стандарт при сравнении различных сладких веществ, которых известно великое множество. Обычно поступают так: готовят сладкий раствор известной концентрации, а затем разбавляют его водой до тех пор, пока не перестанет чувствоваться сладковатый привкус. Одного человека для таких испытаний недостаточно — ведь вкусовая чувствительность у разных людей неодинакова, поэтому определяют усреднённые данные, обобщая показатели членов специальной комиссии экспертов. Опытный дегустатор чувствует присутствие сахарозы в воде при очень малой концентрации — около 10 ммоль/л, или примерно 0,35 г/л. Интересно, что такие сластёны, как пчёлы, в тысячи раз менее чувствительны к сахару, чем человек: они не считают сладким даже раствор, в литре которого 20 г сахара (т. е. двухпроцентный). Этот странный на первый взгляд факт, становится понятным, если учесть, что в цветочном нектаре сахаров куда больше — от 40 до 70 %. И пчела просто не отвлекается на малопитательные продукты. Фруктоза — самый сладкий из природных сахаров, она в 1,7 раза слаще сахарозы, а вот глюкоза, как оказалось, вопреки распространённому мнению, в 1,3 раза менее сладкая, чем обычный сахар. Если же химическим путём заменить в молекуле сахарозы три гидроксильные группы на атомы хлора, получится вещество, которое слаще сахарозы в 2000 раз!
Другой широко распространённый дисахарид — молочный сахар, или лактоза, содержится в молоке (4—5 %). Лактоза в 3 раза уступает сахарозе в сладости. В диетическом питании широкое распространение получили сорбит НОСН2(СНОН)4СН2ОН (от лат. Sorbus aucuparia — «рябина») и ксилит НОСН2(СНОН)3СН2ОН (от греч. «ксилон» — «дерево»). Восстановление глюкозы в сорбит осуществляется в промышленных масштабах при синтезе витамина С. Сладость сорбита в «сахарозных единицах» равна 0,5, тогда как у ксилита она в 4 раза выше. Ощущение сладкого вкуса от этих веществ сохраняется дольше, чем от сахарозы, одновременно они немного «холодят» язык. С химической точки зрения это, собственно, и не сахара' вовсе, а многоатомные спирты вроде глицерина. Вот почему для усвоения сорбита и ксилита не требуется инсулин и их могут употреблять больные сахарным диабетом, организм которых не способен усваивать глюкозу. Применяют их в качестве подсластителей пиши и желающие похудеть: эти вещества малокалорийны.
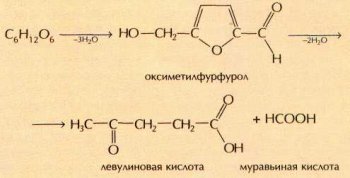
Когда сахар нагревают выше температуры плавления (до 190 °С), он частично разлагается. При этом выделяется вода и образуется карамель. Это аморфная жёлто-бурая вязкая масса, застывающая при охлаждении. В процессе карамелизации часть молекул сахарозы распадается на глюкозу и фруктозу, которые в дальнейшем разлагаются:
Другая часть молекул вступает в реакции конденсации с образованием окрашенных продуктов (например, карамелена С36Н50О25ярко-коричневого цвета). Иногда эти вещества добавляют в некоторые сорта сахара.
Сахароза (тростниковый сахар) была хорошо известна на Древнем Востоке. Её выделяли из сока сахарного тростника, который сгущали и с помощью молока осветляли, а затем промывали известковой водой или раствором золы. Примеси отделялись вместе с образующейся пеной. Сахарный сироп заливали в формы, он медленно кристаллизовался в них, превращаясь в большие куски сахара — сахарные головы. Родиной сахарного тростника считается Индия (слово «сахар» тоже «родом» из Индии: «сакхара» на языке одного из древних народов полуострова означало сначала просто «песок», а затем — «сахарный песок»). Из Индии это растение было вывезено в Египет и Персию; оттуда через Венецию сахар поступал в европейские страны. Долгое время он стоил очень дорого и считался роскошью. Поисками более доступных природных источников сахара занимался немецкий химик Андреас Сигизмунд Маргграф. В трактате, изданном в 1747 г., он описал свои опыты по получению сахара из свёклы. К концу XVIII в. в Германии вывели сорт свёклы с повышенным содержанием сахара — сахарную свёклу. В 1796—1802 гг.
ученик Маргграфа Франц Карл Ахард (1753—1821) разработал способ выделения сахара из свёклы, положивший начало производству сахара не из привозного тростника, а из местного сырья. Постепенно из дорогого лакомства сахар превратился в дешёвый и доступный каждому продукт питания.
Фруктоза была впервые выделена из «медовой воды» в 1792 г. русским химиком Товием Егоровичем Ловицем, а глюкоза открыта в 1802 г. Химия полисахаридов получила развитие после того, как в 1811 г. русский химик Константин Сигизмундович Кирхгоф впервые осуществил гидролиз крахмала.