Жидкости занимают промежуточное положение между газами и твёрдыми веществами. Силы взаимного притяжения молекул в жидкостях достаточно велики, чтобы удерживать молекулы вместе, так что, в отличие от газов, жидкости имеют постоянный объём. В то же время эти силы недостаточны, чтобы держать молекулы в жёсткой упорядоченной структуре, и потому у жидкостей нет постоянной формы.
Если в газах доля свободного объёма составляет более 99%, то в жидкостях — обычно лишь около 3%. То есть плотности жидкостей значительно выше и приближаются к плотностям твёрдых тел. Поскольку молекулы жидкого вещества уже находятся в довольно тесном контакте, сжимаемость жидкостей на много порядков ниже, чем газов.
Во внутреннем объёме жидкости молекулы имеют максимально возможное число «соседей», а на поверхности образуют меньше связей и потому обладают избытком энергии. Этим обусловлено одно из важнейших свойств жидкости — поверхностное натяжение: жидкость всегда стремится уменьшить свою поверхность. Вот почему свободно падающая жидкость принимает форму капли, а в невесомости — форму шара, поверхность которого при данном объёме минимальна.
Газ превращается в жидкость, когда энергия взаимного притяжения молекул превышает их кинетическую энергию (энергию движения). Так как силы межмолекулярного притяжения становятся значимыми только при малых расстояниях между молекулами, сжижению, или конденсации (от лат. condensatio — «сгущение», «уплотнение»), способствует повышение давления. Кроме того, к сжижению ведёт понижение температуры, поскольку кинетическая энергия молекул при этом уменьшается.
Итак, если температуру не снижать, то для конденсации газа необходимо значительное повышение давления. Чем выше температура, тем большее давление надо приложить. В конце концов можно достичь такой температуры, при которой газ невозможно перевести в жидкое состояние ни под каким давлением. Самая высокая температура, при которой газ ещё удаётся превратить в жидкость повышением давления, называется его критической температурой. Соответственно, давление, необходимое для сжижения газа при критической температуре, называется критическим давлением. Критические температура и давление вещества зависят от сил межмолекулярного притяжения, поэтому они индивидуальны для каждого вещества и являются его характеристическими постоянными.
При температурах выше критической вещество находится в особом состоянии. Оно полностью занимает объём сосуда, что свойственно газам. Однако плотность его может быть значительно выше, чем у газов. Поэтому для данной фазы обычно используют название сверхкритический флюид (от лат. fluidus — «текучий»).
Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с другом в любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. Доля свободного объёма, т. е. пространства, не занятого самими молекулами, в газах при нормальных условиях (атмосферном давлении и температуре 0 °С) составляет более 99%. В этом объёме молекулы газов хаотически движутся с большой скоростью, постоянно сталкиваясь друг с другом. Собственно, само слово «газ» происходит от греческого «хаос»; этот термин ввёл в XVII в. нидерландский естествоиспытатель Ян Баптист ван Гельмонт (1579—1644).
При небольших давлениях межмолекулярными взаимодействиями в газах можно пренебречь, т. с. разные газы ведут себя практически одинаково (если говорить о физических, а не химических свойствах). Такое состояние газа называется идеальным и описывается уравнением, связывающим его давление р, объём V, число молей n и температуру Т: pV = nRT, где R — универсальная газовая постоянная (R = 8,31 Дж/(моль•К)=0,082 (л•атм)/(моль • К)).
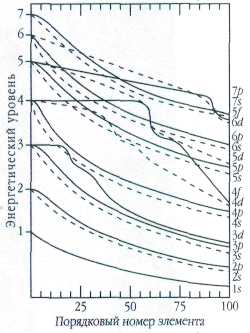
Изменение энергии орбиталей в зависимости от порядкового номера элемента.
Почему же удивительно стройная атомистическая гипотеза древних долго не получала признания? Учение Демокрита и других атомистов натолкнулось на ожесточённое сопротивление Аристотеля. Он показал, что неизбежное для учения об атомах понятие пустоты несёт в себе логическое противоречие: ведь пустота — это «ничто», а как может быть то, чего не существует? Следовательно, пустоты в мире нет, это — абстракция, лишённая смысла. «Natura abhorret vacuum» — «природа не терпит пустоты» {лат.). Данный постулат в течение многих столетий был основой так называемой аристотелевой физики. Из-за огромного авторитета Аристотеля атомная гипотеза строения материи два тысячелетия оставалась на задворках науки...
Вероятно, древнегреческие мыслители первыми высказали предположение о том, что материальный мир един, а потому познаваем. Фалес (около 625 — около 547 до н. э.), наблюдая за различными превращениями веществ, пришёл к выводу, что все они являются разновидностями одного «первичного элемента» — начала всех веществ. Таким элементом Фалес считал воду. Анаксимен (VI в. до н. э.) называл первичным элементом воздух, Гераклит (VI—V вв. до н. э.) — огонь. Аристотель (384-^322 до н. э.) развивал учение о четырёх первоначалах — огне, воздухе, воде и земле. Элементы он считал не материальными субстанциями, подобными обычной воде или земле, а лишь носителями определённых качеств, которыми наделены все тела. Эти качества — теплота, холод, сухость и влажность.
Иначе подошли к учению о строении материи Левкипп (V в. до н. э.) и его ученик Демокрит. Их занимал вопрос о её делимости на всё более мелкие частицы — конечен ли этот процесс или бесконечен? Если деление можно продолжать как угодно долго, значит, материя непрерывна, и её структура принципиально не меняется при любом «увеличении». Если же деление нельзя продолжать бесконечно, рано или поздно мы дойдём до мельчайшей частички, которую Демокрит назвал атомом, что в переводе и означает «неделимый». Тут предполагалась дискретность (от лат. discretus — «прерывистый») материи: между мельчайшими её частичками — пустота.
Многочисленные эксперименты, проведённые физиками в начале XX в.. показали, что атомы состоят из ядер, вокруг которых движутся электроны — в этом отношении атомы напоминают Солнечную систему. Недаром модель атома, предложенную в 1911 г. английским физиком Эрнестом Резерфордом (1871 — 1937), назвали планетарной. Действительно, в Солнечной системе почти вся масса (99,87 %) сосредоточена в центральном светиле, а на планеты приходятся лишь сотые доли процента. Оказывается, в атомах тоже практически вся масса сосредоточена в ядре (в частности, в атоме водорода — 99,95 %).
Но если сравнивать не массы, а размеры, то окажется, что атом намного более «пустой», чем Солнечная система. Её диаметр примерно в 4 тыс. раз больше диаметра Солнца. Размеры же атомов (порядка 10-10 м) приблизительно в 100 тыс. раз превышают размеры ядра (порядка 10-15 м для лёгких ядер)! Если увеличить ядро до 1 мм (булавочная головка), то сам атом вырастет до 100 000 мм = 100 м (размер футбольного поля). Ещё разительнее сопоставление объёмов ядра и атома — получается разница в 15 порядков. Это означает, например, что практически вся масса огромного свинцового куба с ребром 100 м (она равна 11 млн. тонн) сосредоточена в ядрах атома свинца, суммарный объём которых меньше спичечной головки! Трудно даже представить себе, насколько высока плотность ядерного вещества.
Современные понятия элемента, атома и простого вещества, молекулы как совокупности связанных между собой атомов сформировались сравнительно недавно. Но атомистическая теория строения материи — учение о том, что все вещества состоят из мельчайших частиц, — прошла долгий и трудный путь.
Догадки древних, основанные лишь на размышлениях, в принципе, не так уж далеки от нынешних представлений: существуют определённые типы атомов (элементы), которые могут по-разному соединяться друг с другом, давая огромное разнообразие веществ с несхожими свойствами. Такое учение было величайшим достижением человеческого разума. Очень образно об этом сказал американский физик, лауреат Нобелевской премии Ричард Фейнман: «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можно называть её не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Обладает вяжущим, дезинфицирующим, противоцинговым, кровоостанавливающим, мочегонным, потогонным, отхаркивающим, бактерицидным, противовоспалительным, ранозаживляющим действием. Семена применяют как тонизирующее, стимулирующее и укрепляющее средство. Кашицу из семян ярутки полевой используют для наружного лечения ран и ожогов. Настой травы применяют при лечении желудка, малокровии, переутомлениях, импотенции.
В пищу используют молодые листья для приготовления салатов, супов, соусов. Вкус напоминает вкус репы, сильный чесночный запах.
Отвар применяют при колитах, энтеритах, энтероколитах, гемоколитах. Слабые дозы отвара оказывают вяжущее действие, сильные - слабительное.
Из сухих стеблей и семян готовят муку, добавляют к муке зерновых, используют для выпечки хлеба.
Используют для лечения нарушений пищеварения, при внутренних кровотечениях, геморрое, кровохарканье, для стимуляции желчеобразования и желчеотделения. Лисья - как антисептическое при отравлениях и противовоспалительное средство. Корни оказывают благоприятное действие на стенки сосудов, их применяют при поносе, кожных заболеваниях.
При повышенной секреции желудка щавель можно использовать только в ограниченных количествах. Щавелевая кислота понижает усвоение организмом кальция и некоторых других минеральных веществ. Нежелательно употреблять щавель при нарушении кальциево-фосфорного обмена, при подагре, при заболеваниях почек.
Собирают до цветения.
Используют в сыром виде для приготовления щей, супов, борщей, начинки для пельменей и пирогов. Листья щавеля после предварительного подвяливания можно солить, квасить, засахаривать, сушить.
Применяется при заболевании нервной системы, малокровии, гипертонии, сахарном диабете, гипацидном гастрите, энтероколите, нарушениях роста у детей, при переутомлении.
Противопоказания: при почечнокаменной болезни, нефритах, подагре, заболеваниях печени, желчного пузыря и двенадцатиперстной кишки.
Используют молодые листья в свежем и отварном виде. Лучше в качестве салатов.
Чеснок регулирует деятельность пищеварительного тракта, улучшает работу органов дыхания, оказывает сахароснижающее действие, хорошо заживляет раны (обладает бактерицидным и бактериостатическим действием, использовался во время войны как антибиотик). Обладает мочегонным, желчегонным, сосудорасширяющим и укрепляющим действием на мелкие сосуды и капилляры.
Есть его нужно не много, 2-3 зубка. Особенно следует соблюдать осторожность лицам, страдающим нарушением сердечной деятельности (при передозировке могут возникнуть явления спазма сосудов сердца и головного мозга).
В питании используется как приправа, в салатах.