Появление второй статьи Лошмидта окружено некой тайной, которая, вероятно, никогда не будет разгадана. Дело в том, что в первой большой статье (почти 20 страниц) Лошмидт вывел формулу, позволяющую рассчитать значение NL. Однако сам он этот расчёт почему-то не сделал. Если в приведённую формулу подставить известные экспериментальные данные, получится, что NL=1,83•1018 — в 15 раз меньше современного значения (2,687•1019). Во второй статье впервые в научной литературе приводится значение постоянной Лошмидта: «866 биллионов/мм3», т. е. 8,66•1017 молекул/см3. Удивительно, что вторая статья (меньше двух страничек), хотя и подписана именем Лошмидта, по стилю сильно отличается от других его работ. Более того, приведённое в ней значение NL, как говорится, «взято с потолка», а в тексте много ошибок и опечаток...
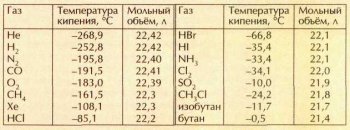
В справочниках можно прочитать, что моль газа при нормальных условиях занимает объём 22,41108 л. Но это справедливо лишь в отношении так называемого идеального газа, для которого принимается, что между молекулами не действуют силы притяжения или отталкивания, а объём самих молекул пренебрежимо мал. Очевидно, что такого газа в природе нет, а реальные газы в большей или меньшей степени отклоняются от законов, писанных для идеального. Между их молекулами всегда существуют силы притяжения, поэтому объём реального газа отличается от объёма идеального. Насколько — зависит от конкретного газа. Вот каковы округлённые мольные объёмы (при нормальных условиях) некоторых газов, рассчитанные из их плотностей:
Тенденция очевидна — чем ближе температура кипения газа к 0 °С, тем сильнее он отличается от идеального. Уравнение для расчёта состояния реальных газов предложил в 1873 г. нидерландский физик Йоханнес Дидерик Ван-дер-Ваальс (1837—1923). В отличие от уравнения идеального газа pV = nRT, в уравнение Ван-дер-Ваальса (р+n2a/V2)(V-nb)=nRT вводятся поправки, которые определяются экспериментом. Первая поправка n2alV учитывает взаимодействие между молекулами реального газа (оно тем меньше, чем больше объём, т. е. чем ниже давление); вторая поправка nb учитывает собственный объём молекул газа.
Поправки становятся существенными при высоких давлениях газов. Так, для азота при давлении порядка 80 атм. расчёт по уравнению идеального и реального газа отличается примерно на 5 %, а с увеличением давления в 5 раз разница достигает уже 100%!
В 30-х гг. XIX в. французский химик Жан Батист Дюма (1800— 1884) исследовал реакцию замещения водорода хлором в органических соединениях. В частности, при хлорировании уксусной кислоты СН3СООН учёный получил трихлоруксусную кислоту CCl3COOH. Однако многие химики отнеслись к работе Дюма с недоверием. Ведь согласно общепринятой тогда теории Берцелиуса, положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора.
Это обстоятельство решил обыграть известный немецкий химик Фридрих Вёлер. В 1840 г. он передал своему другу, не менее известному учёному и издателю «Анналов химии» Юстусу Либиху статью от имени некоего Ш. Виндлера (Schwindler по-немецки — «мошенник») о новом удачном приложении открытой Дюма реакции. В статье с явной издёвкой говорилось о том, как в уксуснокислом марганце Мn(СН3СОО)2 (его тогда изображали так: МnО•С4Н6О3) удалось все элементы заместить на хлор и в результате получить жёлтое кристаллическое вещество, состоящее из одного только хлора: Cl2Cl2•Cl8Cl6Cl6. Далее сообщалось, будто в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные и при этом веши сохраняют свой внешний вид. В примечании было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, поскольку такая ткань очень хороша для ночных колпаков и тёплых подштанников.
Либиху шутка понравилась, и он опубликовал сочинение Ш. Виндлера (на французском языке) всего через несколько страниц после статьи Дюма. Намёк получился очень прозрачным. Тем не менее прав оказался всё же Дюма.
Свойства газов в конце XVIII — начале XIX в. исследовали многие учёные. Так, зависимость между обьёмом газа и температурой (при постоянном давлении) ещё до Гей-Люссака изучал французский физик Жак Александр Сезар Шарль (1746—1823). Однако он вовремя не опубликовал полученные данные, Гей-Люссак же чётко сформулировал закон, который у нас называют законом Гей-Люссака, а, например, в Англии и США — законом Шарля. С зависимостью давления газа от абсолютной температуры (при постоянном объёме) всё наоборот: в нашей стране он известен как закон Шарля, а в Англии и США — как закон Гей-Люссака. Иногда эти законы называют соответственно первым и вторым законами Гей-Люссака.
Любопытно, что оба учёных прославились также своими полётами на воздушных шарах. В декабре 1783 г. Шарль вместе с коллегой Франсуа Робером в присутствии 400 тыс. зрителей предпринял первый полёт на воздушном шаре, заполненном водородом. Гей-Люссак, тоже на пару с физиком Жаном Батистом Био, поставил в 1804 г. рекорд высоты, поднявшись на 7000 м.
Французский учёный Жозеф Луи Гей-Люссак (1778—1850) прославился и как физик, и как химик. Его имя носят газовые законы, которые сыграли большую роль в разработке атомно-молекулярного учения. В 1802 г. Гей-Люссак установил, что объём газа при постоянном давлении увеличивается пропорционально температуре.
Несколько позже он сформулировал ещё один закон: давление газа в замкнутом объёме также пропорционально температуре.
В 1808 г. Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал важнейший для развития химии закон объёмных отношений. Согласно ему, реагирующие газы соединяются таким образом, что соотношение между их объёмами, а также объёмом газообразного продукта реакции выражается простыми целыми числами (при условии, что температура и давление остаются постоянными). Например, 2 объёма водорода соединяются с 1 объёмом кислорода, давая 2 объёма водяного пара; 1 объём хлора реагирует с 1 объёмом водорода, что даёт 2 объёма нового газа — хлороводорода; 3 объёма водорода и 1 объём азота образуют 2 объёма аммиака, и т. д. Сейчас мы записали бы стехиометрические уравнения реакций просто и лаконично: 2Н2+О2=2Н2О; Сl2+Н2=2НСl; ЗН2+N2=2NH3. Но в те времена ещё не было чёткого разграничения понятий атома и молекулы, не существовало и современных обозначений химических элементов, формул их соединений.
О соотношении химии и математики, помимо Канта, высказался также французский учёный Огюст Конт, основатель философии позитивизма и автор формальной классификации наук. И причём высказался прямо противоположным образом. «Любую попытку применить математические методы при изучении химических вопросов, — писал Конт в 1830 г., — следует рассматривать как абсолютно неразумную и противоречащую духу химии... Если когда-нибудь математический анализ займёт в химии видное место — что, к счастью, почти невозможно, — то это приведёт к быстрому и полному вырождению этой науки».
Для нас высказывание Конта звучит более чем странно, но два столетия назад многие химики нетвёрдо знали даже... четыре правила арифметики. Доказательством может служить труд Рихтера «Начальные основания стехиометрии», в котором он объясняет своим коллегам: «Если одно число прибавляется к другому, то между ними следует поместить знак „+" (который называется плюсом), если же мы хотим произвести вычитание, то между ними ставится знак „-" (который называется минусом). Например, 19 + 424 Означает, что мы прибавляем 19 к 424, что даёт 443; а запись 424 - 19 означает, что мы отнимаем 19 от 424, что даёт 405»
Выдающийся немецкий философ Иммануил Кант как-то заметил, что в некоторых ветвях естественных наук истинной науки столько, сколько в них математики. Эти слова произвели глубокое впечатление на немецкого химика Иеремию Вениамина Рихтера (1762—1807): даже свою докторскую диссертацию он назвал «Использование математики в химии». А ещё Рихтер сформулировал правило, которым химики пользуются уже более двух столетий. Основываясь на результатах собственных экспериментов, а также работ предшественников, он вывел закон, согласно которому вещества взаимодействуют в строго определённых соотношениях, причём массы и исходных веществ, и продуктов реакции можно рассчитать заранее. Впервые в истории химии Рихтер записал количественные уравнения реакций, позволяющие, как выразился бы современный химик, рассчитать теоретический выход продукта.
Все эти идеи, известные сейчас даже школьнику, Рихтер изложил в 1793 г. в своём главном труде «Начальные основания стехиометрии». Введённое им понятие стехиометрии (от греч. «стойхеон» — «основание», «элемент» и «метрео» — «измеряю»), т. е. массовых или объёмных соотношений реагирующих веществ, стало одним из ключевых в химии.
Плазма — электрически нейтральный, сильно ионизированный газ, состоящий из положительно заряженных ионов, электронов и нейтральных молекул. Во многих отношениях плазма ведёт себя как обычный газ и подчиняется законам газовой динамики.
Чтобы превратить газ в плазму (ионизировать его), нужно затратить большую энергию, которая называется энергией ионизации. Легче всего ионизируются пары щелочных металлов (энергия ионизации цезия — 375 кДж/моль), труднее всего — благородные газы (для гелия энергия ионизации равна 2372 кДж/моль). Плазма возникает в разрядах молний, в пламени. Верхние слои атмосферы Земли также представляют собой плазму, образовавшуюся под действием солнечного излучения.
Плазму можно создавать искусственно, подвергая нейтральный разреженный газ действию электрического поля (как в лампах дневного света) или очень высоких температур.
Звёзды состоят из высокоионизированной плазмы, в которой атомы теряют уже не один внешний, а все электроны, для чего требуются колоссальные температуры. Так, для потери атомом бериллия одного электрона необходима энергия 900 кДж/моль, чтобы оторвать второй электрон, нужно уже 17бО кДж/моль, третий — 14 850 кДж/моль, а четвёртый (и последний) — 20 900 кДж/моль! Чтобы атомы при столкновениях имели такую кинетическую энергию, вещество надо нагреть почти до 2 млн. градусов.
Однако до сегодняшнего дня никто не замечал, чтобы оконное стекло стекало в сторону подоконника. Если бы стекло хоть в малейшей степени было текучим, люди не могли бы строить современные мощные оптические телескопы, такие, например, как самый крупный в мире телескоп в чилийской пустыне Атакама, названный «Очень большим оптическим». Диаметр его зеркала 8,2 м. Точность шлифовки зеркала исключительно высока, малейшие деформации стекла недопустимы.
С другой стороны, при исследовании средневековых витражей, изготовленных из цветных стёкол, выяснилось: в нижней части они толще, чем в верхней. Некоторые учёные сделали вывод, что это следствие очень медленного, на протяжении многих веков, течения стекла под действием собственного веса, и даже предложили использовать данное свойство для установления времени изготовления старинных стёкол. У химиков существовало поверье, что длинные стеклянные трубки и палочки нельзя долго хранить в вертикальном положении, так как они постепенно изгибаются. Об этом можно было прочитать ещё в начале XX в. в книге известного немецкого учёного, лауреата Нобелевской премии по химии Вильгельма Оствальда (1853—1932) «Физико-химические исследования».
В твёрдом веществе каждая молекула удерживается межмолекулярными силами в определённом положении относительно своих соседей. Твёрдые тела обладают очень малой сжимаемостью, поскольку доля свободного объёма в них обычно ещё меньше, чем в жидкостях. Так что плотность данного вещества в твёрдом состоянии, как правило, больше, чем в жидком. Одним из исключений является вода, плотность которой при нормальном давлении выше плотности льда.
Большинство твёрдых веществ находится в кристаллической форме: их частицы — молекулы, атомы или ионы — расположены в строгом порядке, образуя регулярную пространственную структуру — кристаллическую решётку. Поэтому при переходе жидкости в твёрдое состояние молекулы ведут себя подобно солдатам, получившим команду к построению.
Вместе с тем частицы в кристаллической решётке не неподвижны, они постоянно совершают колебательные движения. Если частицы, расположенные на поверхности твёрдого вещества, приобретают энергию, достаточную для преодоления силы притяжения остальных частиц в кристалле, то они «улетают», образуя пар. Все твёрдые вещества имеют определённое давление пара, хотя оно обычно очень мало, особенно для ионных кристаллов. Так, для NaCl давление пара, равное всего 0,001 мм рт. ст.
Жидкости занимают промежуточное положение между газами и твёрдыми веществами. Силы взаимного притяжения молекул в жидкостях достаточно велики, чтобы удерживать молекулы вместе, так что, в отличие от газов, жидкости имеют постоянный объём. В то же время эти силы недостаточны, чтобы держать молекулы в жёсткой упорядоченной структуре, и потому у жидкостей нет постоянной формы.
Если в газах доля свободного объёма составляет более 99%, то в жидкостях — обычно лишь около 3%. То есть плотности жидкостей значительно выше и приближаются к плотностям твёрдых тел. Поскольку молекулы жидкого вещества уже находятся в довольно тесном контакте, сжимаемость жидкостей на много порядков ниже, чем газов.
Во внутреннем объёме жидкости молекулы имеют максимально возможное число «соседей», а на поверхности образуют меньше связей и потому обладают избытком энергии. Этим обусловлено одно из важнейших свойств жидкости — поверхностное натяжение: жидкость всегда стремится уменьшить свою поверхность. Вот почему свободно падающая жидкость принимает форму капли, а в невесомости — форму шара, поверхность которого при данном объёме минимальна.
Газ превращается в жидкость, когда энергия взаимного притяжения молекул превышает их кинетическую энергию (энергию движения). Так как силы межмолекулярного притяжения становятся значимыми только при малых расстояниях между молекулами, сжижению, или конденсации (от лат. condensatio — «сгущение», «уплотнение»), способствует повышение давления. Кроме того, к сжижению ведёт понижение температуры, поскольку кинетическая энергия молекул при этом уменьшается.
Итак, если температуру не снижать, то для конденсации газа необходимо значительное повышение давления. Чем выше температура, тем большее давление надо приложить. В конце концов можно достичь такой температуры, при которой газ невозможно перевести в жидкое состояние ни под каким давлением. Самая высокая температура, при которой газ ещё удаётся превратить в жидкость повышением давления, называется его критической температурой. Соответственно, давление, необходимое для сжижения газа при критической температуре, называется критическим давлением. Критические температура и давление вещества зависят от сил межмолекулярного притяжения, поэтому они индивидуальны для каждого вещества и являются его характеристическими постоянными.
При температурах выше критической вещество находится в особом состоянии. Оно полностью занимает объём сосуда, что свойственно газам. Однако плотность его может быть значительно выше, чем у газов. Поэтому для данной фазы обычно используют название сверхкритический флюид (от лат. fluidus — «текучий»).