В XVII—XVIII вв., в период расцвета теории флогистона, считали, что уголь полностью состоит из этого таинственного вещества: ведь при горении угля почти не образуется твёрдого остатка. И только A. JI. Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь — всего лишь простое вещество. Лавуазье назвал новый элемент Carboneum вместо старого латинского названия car-bone pur — «чистый уголь», которым долгое время пользовались химики.
Алмаз является одним из самых твёрдых и тугоплавких (tпл>4000 °С) веществ. В то же время алмаз хрупок: его довольно легко расколоть на части. Аля этого ювелиры пользуются ножом, по которому ударяют молотком. Немногие знают, что алмаз обладает очень высокой теплопроводностью — проводит тепло лучше, чем многие металлы (в 4 раза лучше Cu). В то же время он не проводит электрический ток.
Подобно своим предшественникам по подгруппе, таллий тоже был обнаружен с помощью спектроскопа. Английский химик Уильям Крукс (1832— 1919) занимался извлечением селена из отходов сернокислотного производства. В 1861 г. учёный решил проанализировать собранную им пыль, содержащую селен, — он задался вопросом, нет ли в ней примеси теллура. Каково же было изумление Крукса, когда в спектроскопе он увидел незнакомую ему линию ярко-зелёного цвета, которая принадлежала новому химическому элементу. Его название происходит от греч. «таллос» — «зелёная ветка».
Таллий — это серебристо-белый металл с голубоватым оттенком (tпл=303 °С). В отличие от алюминия,
индия и галлия, оксидная плёнка не спасает его от окисления: на воздухе он быстро темнеет, покрываясь тонким слоем оксида Тl2О. Хранят таллий, как и щелочные металлы, в керосине.
В 1863 г., исследуя с помощью спектроскопа цинковую обманку, директор Фрайбергской горной академии (Германия) Фердинанд Райх (1799—1882) и его ассистент Теодор Иероним Рихтер (1824—1875) обнаружили две линии интенсивного синего цвета, сходного с цветом красителя индиго. Эти линии принадлежали новому элементу, получившему наименование «индий» (от названия «индиго», которое в свою очередь происходит от лат. indikus — «индийский»).
Соединения индия встречаются в незначительном количестве в свинцово-цинковых и медных сульфидных рудах.
Чистый индий — пластичный серебристо-белый металл (tпл=157 °С), устойчивый на воздухе и настолько мягкий, что легко режется ножом.
Индий, как и галлий, используется для получения полупроводниковых материалов: InAs, InSb и др. Введение индия в кремний и германий улучшает их полупроводниковые свойства. Плёнки из оксида индия применяют в электронике в качестве прозрачных электропроводящих покрытий для экранов дисплеев, фотоэлементов.
Галлий принадлежит к числу элементов, открытие которых было предсказано Д. И. Менделеевым. В 1871 г. учёный определил его место в периодической системе, описал основные свойства и даже предположил, что элемент откроют методом спектрального анализа. Слова великого химика оказались пророческими.

Прокаливая на воздухе смесь глины, угля и сульфата натрия, можно получить синюю краску — ультрамарин. Раньше его использовали и для отбеливания белья, льна, крахмала. Примерный состав ультрамарина соответствует формуле Na8Al6Si6О24S. Окраска этого вещества обусловлена наличием в нём атомов серы (точнее, групп S-2, S-3), расположенных а полостях алюмосиликатного каркаса. Под действием соляной кислоты ультрамарин обесцвечивается с выделением сероводорода. В щелочной среде ультрамарин устойчив.
В лабораторной практике в качестве восстановителя обычно используют не чистый алюминий, а сплав Деварда, содержащий 50% меди, 45% алюминия и 5% цинка. Этот сплав, легко растирающийся в порошок, вытесняет водород не только из разбавленных кислот, но и из воды. Активным веществом, входящим в его состав, является всё тот же алюминий, однако в контакте с медью его восстановительные свойства возрастают (образуется медно-алюминиевый гальванический элемент). Сплав Деварда восстанавливает в щелочном растворе нитрат- и нитрит-ионы до аммиака, что используется в химическом анализе.
«Если металлический алюминий облить (или даже просто смочить) раствором сулемы (дихлорида ртути HgCl2. — Прим. ред.), ртуть восстановляется и даёт амальгаму, в виде которой алюминий окисляется очень легко и разлагает воду при обыкновенной температуре...
При обыкновенной температуре металлический алюминий воды не разлагает, но если к ней прибавить немного иода, или йодистого водорода и иода, или йодистого алюминия и иода, водород в обилии выделяется», — читаем в «Основах химии» Д. И. Менделеева.
Лишённый оксидной плёнки, алюминий активно взаимодействует с водой: 2Al + ЗН2О=2АКОН)3¯+3Н2, а на воздухе быстро окисляется, при этом металл нагревается и обрастает белой «бородой» оксида: 4Al + 3О2=2Al2О3. Оксид и гидроксид алюминия амфотерны, т. е. вступают в реакцию как с кислотами (с образованием солей алюминия, например AlCl3), так и с щелочами (образуя алюминаты: Na[Al(OH)4] — в растворе или NaAlO2 — при сплавлении с твёрдой щёлочью). Интересно, что выдержанный при высоких температурах Al2О3 становится инертным — утрачивает способность к взаимодействию даже с концентрированными кислотами.
Алюмотермией называют метод восстановления металлов из оксидов порошком металлического алюминия. Так можно получить корольки (маленькие слитки) многих переходных металлов, например хрома, марганца, ванадия, железа:
2Al+Fe2O3=Al2O3+Fe. Если поджечь с помощью магниевой ленты смесь, состоящую из алюминия и оксида железа, а после этого остывший тигель разбить молотком, из образовавшейся массы (пека) нетрудно извлечь королёк металла.
В 1880 г. в колледж маленького американского городка Оберлин близ Кливленда (штат Огайо) поступил Чарлз Мартин Холл (1863—1914). В том же голу профессором химии и минералогии этого колледжа стал 36-летний Фрэнк Фаннинг Джуэтт. Встреча первокурсника и преподавателя оказалась решающей в истории алюминия. Джуэтт ранее стажировался в Германии, работал у знаменитого химика-органика Фридриха Вёлера, обсуждал с ним проблемы получения алюминия. С собой в Америку Джуэтт привёз и образец редкого металла.
Холл увлёкся химией ещё в детстве. Он нашёл старый учебник химии своего отца и усердно штудировал его, ставил опыты. Однажды мать даже устроила ему нагоняй за порчу обеденной скатерти после самодельного фейерверка. А спустя десять лет Холл стал первым человеком, получившим алюминий электролизом. Впоследствии Джуэтт описал, как это произошло:
«Моим самым важным открытием было открытие человека. В 1880 году я обратил внимание на мальчика лет шестнадцати. Он регулярно заходил в химическую лабораторию, чтобы купить на несколько центов стеклянные трубки, пробирки и тому подобное. Я ничего не знал об этом мальчике, но подумал, что когда-нибудь его имя станет известным: ведь он уже проводит опыты, когда другие думают только об играх и развлечениях. Это был Чарлз М. Холл, который в возрасте 21 года открыл способ восстановления алюминия из руды и таким образом сделал алюминий тем замечательным металлом, которым теперь широко пользуются во всём мире...».
Во многих популярных книгах по химии приводится легенда о том, что некий мастер, имя которого история не сохранила, принёс римскому императору Тиберию (14—27 гг. н. э.) чашу из металла, напоминающего серебро, но более лёгкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы.
Эта легенда основана на рассказе Плиния Старшего, приведённом в «Естественной истории». Согласно Плинию, похожий на серебро металл был получен из «глинистой земли». Глинозём — это гидратированный оксид алюминия Аl2О3•nН2О, а белая глина (каолин) — алюмосиликат:
Al2O3•2SiO2•2Н2O.
Алюминий называют металлом XX века. Когда его открыли в 1825 г., он стоил в 1500 раз дороже железа (сейчас — втрое). Лаже 30 лет спустя на его слиток, демонстрировавшийся на Всемирной выставке в Париже, смотрели как на драгоценность. И это неудивительно: для восстановления алюминия из его руд необходимо затратить очень большое количество энергии.
Алюминий прочно вошёл в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока.
Изделия из алюминия.
А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 г. килограмм металла стоил 1200 долларов — дороже золота! Почему же со временем цена на алюминий так упала? Ответ прост: алюминий широко распространён в земной коре (8%), уступая в этом лишь кислороду и кремнию. «Достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в коре земной. «...Алюминий, или металл квасцов (alumen), потому и называется иначе глинием, что находится в глине», — писал Д. И. Менделеев. Белая глина, или каолин Аl2О3•2SiO2•2Н2О, рождается при выветривании алюмосиликатов, например полевого шпата ортоклаза К2О•Аl2О3•6SiO2, слюды К2О•3Аl2О3•6SiO2•2Н2О, нефелина (Na, К)2О•Аl2О3•2SiO2. Одновременно с глиной при этом образуются кварцевый песок SiO2, бокситы Аl2О3•2Н2О и корунд Аl2О3. Окрашенные кристаллы корунда — это широко известные драгоценные камни рубин и сапфир.
При сплавлении оксида алюминия с порошками основных оксидов (например, магния, кальция, кобальта) образуются вещества, которые долгое время рассматривали как соли «алюминиевой кислоты» HAlO2 или метаформы гидроксида алюминия AlOOH. Исследование структуры этих соединений показало, что многие из них представляют собой сложные оксиды, в кристаллической решётке которых катионы двух металлов находятся в пустотах между ионами кислорода. Такое строение, в частности, имеет тенарова синь, образующаяся при прокаливании оксида алюминия с оксидом кобальта (II) при 1100 °С: СоО+Al2O3=CoAl2O4. Это вещество (tпл=1960 °С) используется в качестве синей краски, например, в производстве гжельской керамики.

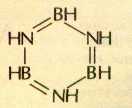
Бор образует с азотом и водородом несколько интересных соединений, которые можно рассматривать как аналоги углеводородов: боразан
ВН3—NH3 (аналог этана); боразен BH2=NH2 (аналог этилена); боразин BHºNH (аналог ацетилена).
Подобно тому как из ацетилена может быть получен бензол, из боразина образуется боразол (неорганический бензол) — бесцветная горючая жидкость (tкип=55 °С) с характерным запахом: