В XVII—XVIII вв., в период расцвета теории флогистона, считали, что уголь полностью состоит из этого таинственного вещества: ведь при горении угля почти не образуется твёрдого остатка. И только A. JI. Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь — всего лишь простое вещество. Лавуазье назвал новый элемент Carboneum вместо старого латинского названия car-bone pur — «чистый уголь», которым долгое время пользовались химики.
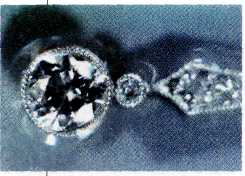
Алмаз является одним из самых твёрдых и тугоплавких (tпл>4000 °С) веществ. В то же время алмаз хрупок: его довольно легко расколоть на части. Аля этого ювелиры пользуются ножом, по которому ударяют молотком. Немногие знают, что алмаз обладает очень высокой теплопроводностью — проводит тепло лучше, чем многие металлы (в 4 раза лучше Cu). В то же время он не проводит электрический ток.
Алмаз. При слове «алмаз» сразу же вспоминаются окутанные завесой тайны истории, повествующие о поисках сокровищ. Когда-то люди, охотившиеся за алмазами, и не подозревали, что предметом их страсти является кристаллический углерод — тот самый углерод, который образует сажу, копоть и уголь. Впервые это доказал Лавуазье. Он поставил опыт по сжиганию алмаза, используя собранную специально для этой цели зажигательную машину. Оказалось, алмаз сгорает на воздухе при температуре около 700 °С, не оставляя твёрдого остатка, как и обычный уголь.
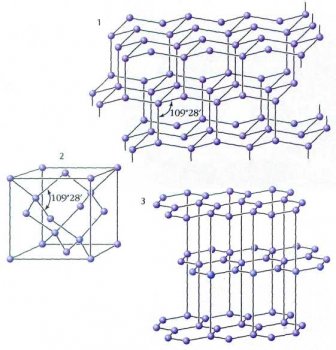
В структуре алмаза каждый атом углерода имеет четырёх соседей, которые расположены от него на равных расстояниях в вершинах тетраэдра (угол С—С—С составляет 109° 28'). Весь кристалл представляет собой единый трёхмерный каркас.
Кристаллические структуры различных модификаций углерода:
1 — гексагональный алмаз (лонсдейлит);
2 — кубический алмаз;
3 — графит.
Часто алмазы имеют тот или иной оттенок (нацвет, как говорят ювелиры). Известны алмазы оранжевого, голубого, розового, жёлтого, коричневого, молочно-белого, синего, зелёного, серого и даже чёрного цвета. Окраска связана как с дефектами в их кристаллической структуре, так и с замещением части атомов углерода на атомы бора, азота и даже алюминия. Серая и чёрная окраска алмазов обусловлена включениями графита.
С этим связаны многие свойства алмаза, в частности его самая высокая среди минералов твёрдость. Она-то и дала камню имя, которое происходит от греч. «адамас» — «твёрдый», «непреклонный», «несокрушимый».
Кристаллы алмаза, особенно огранённые (бриллианты), очень сильно преломляют свет. Этим и обусловлена знаменитая «игра бриллиантов».
В России ювелирные алмазы вошли в моду в середине XVIII в. Ими украшали не только царские диадемы и скипетры, но также брелки, застёжки, трости, табакерки и даже обувь! Мелкие алмазы используются для резки стекла и металлов, служат наконечниками свёрл, резцов. Алмазный порошок издревле применяют для полировки и огранки драгоценных камней.

Графит. В древности графит считали одним из минералов свинца, возможно из-за того, что, подобно свинцу, он оставляет на бумаге след (поэтому из графита делают грифели). В XVIII в. К. В. Шееле доказал, что графит представляет собой «особый минеральный уголь». Родственные отношения между алмазом и графитом были подробно изучены коллегой Лавуазье французским химиком Луи Бернаром Гитоном де Морво (1737—1816): при осторожном нагревании алмаза без доступа воздуха он получил порошок графита.
Графит — мягкое вещество серого цвета. Атомы углерода связаны в нём в плоские слои, состоящие из соединённых рёбрами шестиугольников, наподобие пчелиных сот. Каждый атом в таком слое имеет трёх соседей, угол между связями С—С—С равен 120°. Для образования трёх ковалентных связей атом предоставляет три электрона, а четвёртый электрон, образуя p-связи, делокализован по всему кристаллу. Этим объясняются такие свойства графита, как металлический блеск и электропроводность.
Поскольку электронные облака атомов из соседних плоских слоёв перекрываются, между слоями возникают слабые связи, которые рвутся даже при незначительной нагрузке. Для того чтобы в этом убедиться, достаточно провести карандашом по листу бумаги: на листе останется след из чешуек графита.
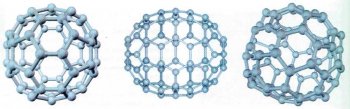
Строение фуллеренов С60, С70, С72. Фуллерен С70 имеет форму сплющенного шара или дыни.
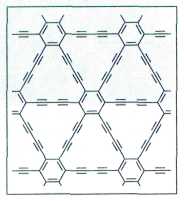
Графин — ещё одна аллотропная модификация углерода. В конце XX в. учёные разрабатывают пути синтеза графинов — веществ со слоистой структурой, аналогичной графиту. Каждый слой графина состоит
Растворы С60 (слева) и С70 (справа) в толуоле и кристаллы С60. Фуллерены хорошо растворимы в органических растворителях — бензоле, толуоле, четрёххлористом углероде. Это свойство используют для отделения фуллеренов от сажи.
В отсутствие кислорода графит и алмаз выдерживают нагревание до высоких температур: эти вещества переходят в газовую фазу в виде молекул Сn (1<n<10) лишь при 3000 °С. Поэтому графит используют как теплозащитный материал для головных частей ракет.
Карбин.
сажи, бурого и каменного угля) лежит разупорядоченная структура графита. Однако в 60-х гг. XX в. в природном графите были обнаружены белые кристаллы карбина — ещё одной аллотропной модификации.
Это вещество состоит из цепей, образованных атомами углерода. Известно несколько форм карбина, различающихся строением цепи, например —CºС—CºС— и =С=С=С=С=. Учёные установили, что карбин образуется при возгонке графита при температуре 2000 °С и низком давлении.
Фуллерены. И алмаз, и графит, и карбин имеют немолекулярное строение, т. е. состоят из каркасов, сеток или цепей атомов углерода.
В 1996 г. трое учёных — Гарольд Крото (Великобритания), Роберт Керл и Ричард Смелли (США) — были удостоены Нобелевской премии в области химии за открытие в 1985 г. молекулярной формы углерода — фуллерена. К фуллеренам относят вещества с чётным числом атомов углерода в молекуле: С60, С70, С72, С74, С7б,..., C108,.., С960,.., C1020 и др. Эти замечательные молекулы составлены из атомов углерода, объединённых в пяти- и шестиугольники с общими рёбрами. Название своё они получили по фамилии американского архитектора и инженера Ричарда Бакминстера Фуллера, который построил на выставке в Монреале в 1967 г. павильон США, используя конструкцию из сочленённых пяти- и шестиугольников.
В 1990 г. было изучено строение простейшего фуллерена, содержащего 60 атомов углерода. Это бакминстерфуллерен. Молекула Сб0 напоминает футбольный мяч: она состоит из 12 пятиугольников и 20 шестиугольников. Такой многогранник имеет высокую симметрию, близкую к сферической. Каждый атом углерода в молекуле Сб0, как и в графите, связан с тремя другими атомами. В первых опытах фуллерены получали испарением графита в атмосфере гелия под действием мощного лазерного импульса. Позднее обнаружили, что фуллерены образуются при пропускании гелия через электрическую дугу между графитовыми электродами. В оседающей на стенках реактора саже содержится до 15% фуллеренов. Фуллерены представляют собой кристаллические вещества чёрного цвета с металлическим блеском, обладающие свойствами полупроводников. При давлении порядка 2•105 атм и комнатной температуре бакминстерфуллерен превращается в алмаз. При температуре около 800 °С фуллерен С60 возгоняется, молекулы С60 присутствуют в газовой фазе вплоть до температуры 1800 °С.
В 1992 г. фуллерены обнаружены в природе — в минерале шунгите (аморфном углероде), названном в честь посёлка Шуньга в Карелии. Неудивительно, что долгое время примесь фуллерена в шунгите не замечали: его там лишь около 0,001%.
Химия углерода. Углерод (в форме графита) легко вступает в химические реакции. Он взаимодействует с кислородом, серой и фтором, однако инертен по отношению к остальным галогенам, азоту, фосфору. В реакции с серой (при 650 °С) образуется сероуглерод CS2 — легколетучая ядовитая жидкость, используемая в качестве растворителя.
Сплавлением сажи с активными металлами получают карбиды. Их строение и свойства зависят от природы металла. Так, карбиды магния, алюминия и щёлочноземельных Карбиды переходных металлов (например, Fe3C) инертны по отношению к воде, растворам кислот и щелочей. Переходные металлы IV, V и VI групп периодической системы образуют карбиды состава МС (TiC, NbC). Они представляют собой необычайно твёрдые вещества с металлическим блеском и часто с металлической проводимостью. Эти соединения имеют рекордно высокие температуры плавления: 3000-4000 °С. Они являются компонентами жаропрочных сплавов и специальных сортов керамики.
металлов легко разлагаются водой. При гидролизе карбидов алюминия и бериллия образуется метан:
Ве2С+4Н2О=2Be(OH)2¯+СН4 Al4С3+12Н2О = 4Al(OH)3¯+3СН4,
при гидролизе карбида магния Mg2C3 — смесь двух изомеров: метилацетилена СН3—ОºСН и аллена СН2=C=СН2:
Mg2C3+4Н2О=2Mg(OH)2¯+С3Н4, а при гидролизе карбидов щёлочноземельных металлов — ацетилен:
СаС2+2Н2О=Са(ОН)2¯+С2Н2.
Последняя реакция используется на стройках для получения ацетилена, необходимого при сварочных работах. В промышленности серый порошок карбида кальция получают, прокаливая известь с углём: СаСО3+4С=СаС2+3СО. Карбид кальция — ионное соединение (Са2+С2-2) с высокой температурой плавления (2160 °С)


Похожие статьи