Большинство органических реакций сопровождается перераспределением электронной плотности, т. е. являются окислительно-восстановительными. Однако сложность определения степени окисления элементов в органических молекулах заставляет химиков-органиков ввести дополнительные критерии того, является ли процесс окислительно-восстановительным. Под окислением в органической химии понимают процесс присоединения молекулой атомов кислорода или потери водорода, например:
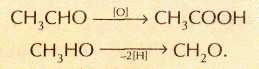
Обратный процесс, приводящий к увеличению числа атомов водорода или потере атомов кислорода, принято называть восстановлением:
Одни из самых распространённых комплексов металлов — карбонилы. Если в комплексе один атом металла, его называют моноядерным. Например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4 и т. п. При облучении Fe(CO)5 ультрафиолетовым светом образуется биядерный комплекс Fe2(CO)9, затем триядерный Fe3(CO)12 и т. д. При конденсации карбонилов могут образовываться сложные структуры, содержащие остов из многих атомов металла — Rh6(CO)l6, Os20(CO)2-40 и т. п. Это похоже на «гроздь» связанных друг с другом атомов металлов. Отсюда и название — кластер (англ cluster — «гроздь»). Важнейшая отличительная особенность кластерных — присутствие в них химически связанных друг с другом атомов металлов.
Со времени открытия соли Цейзе были получены олефиновые комплексы для большинства переходных металлов. Олефиновый лиганд, как и очень похожий на него ацетиленовый, являются донорами двух электронов, что и определяет устойчивость таких комплексов.
Обычно олефиновый лиганд достаточно подвижен и легко замещается на другие. Прочность его связи с металлом в большой степени определяется количеством атомов в лиганде, которые связаны с атомом металла. Например, циклопентадиенильный лиганд связан с атомом металла сразу пятью атомами — в элементоорганической химии его называют пентагептолиганд и обозначают h5-С5Н5. Вытеснить такой лиганд из молекулы непросто. Алкены, в том числе и этилен, являются дигепталигандами, т. е. связаны с металлом только двумя атомами углерода.
Органические соединения селена и теллура пользуются дурной славой среди химиков. Для работы со многими из них, в особенности с легколетучими соединениями, требуется специальная техника. Так, в одной из научных публикаций авторы сообщали, что для проведения опытов с алкильными производными селена пришлось построить отдельную лабораторию. И не из-за особой токсичности или взрывоопасности, а из-за запаха! В современной англоязычной научной литературе соединения селена и теллура удостоились эпитетов «зловонный» и «смрадный». Но невзирая на это химики активно работают с такими веществами — на основе органических производных серы и селена получены полимеры с высокой электропроводностью, настоящие «органические металлы»!
Соли типа [TMeTSeF]+BF-4 обладают электропроводностью на уровне обычных металлов. Более того, сопротивление у них при охлаждении падает значительно быстрее, чем у металлов. Учёные надеялись, что температура перехода в сверхпроводящее состояние у них будет достаточно высокой. Однако выяснилось, что при охлаждении до -100 °С сопротивление скачкообразно увеличивается и они становятся изоляторами. Оказалось, что в обычных условиях молекулы «органических металлов» образуют проводящие цепочки. При -100 °С эти цепочки распадаются и проводимость исчезает.
Мышьякорганические соединения вполне могут считаться «патриархами» среди элементоорганических соединений. Их история началась ещё в 1760 г., когда фармацевт французской армии Луи Клод Кадэ (1731— 1799) проводил перегонку ацетата калия с оксидом мышьяка(III). Сейчас уже сложно установить, что было целью того эксперимента. В результате же получилась жидкость с отвратительным чесночным запахом, самовоспламеняющаяся на воздухе. Поскольку это было явно не то, что хотел получить любознательный аптекарь, то исследовать жидкость он не стал.
Про загадочное соединение вспомнили только в следующем веке. Роберт Бунзен, изучая жидкость Кадэ, обнаружил в ней углерод, кислород, водород и мышьяк. В роли «крёстного отца» выступил Якоб Берцелиус, выделивший это вещество в чистом виде. Формула жидкости Кадэ — (CH3)2As—О—As(CH3)2, а название — окись какодила (от греч. «какос» — «дурной» и «одорос» — «запах»).
Если в неорганических соединениях свинец чаще всего двухвалентен, то для элементоорганических более характерна валентность свинца, равная четырём. Тетраэтилсвинец был известен ещё с 1853 г. Длительное время, начиная с 1923 г., он использовался как антидетонатор в моторном топливе (см. статью «Бесценное топливо»).
Это приводило к сильному загрязнению окружающей среды. Кроме того, соединения свинца быстро выводили из строя катализаторы очистки выхлопных газов от оксида углерода. В результате количество фильтров на выхлопной трубе стало резко увеличиваться, а сам автомобиль начал превращаться в химическую лабораторию в миниатюре. Дешевле оказалось получать более дорогой, но в то же время более качественный бензин, чем решать проблемы с очисткой от свинца продуктов сгорания этилированного бензина.
Широкое применение в самых разных областях получили и оловоорганические соединения. В основном они используются как стабилизаторы одного из самых распространённых пластиков — поливинилхлорида. Чистый поливинилхлорид начинает разлагаться и темнеть при 110 °С, тогда как его термическая переработка возможна только при 180 °С. Добавление производных диоктилстаннана типа (C8H17)2Sn(SCH2COOC8H17)2значительно повышает температуру разложения этого полимера, и его обработка становится гораздо легче.
Некоторые оловоорганические соединения довольно токсичны, в отличие от малотоксичных неорганических производных этого металла. Так, весьма ядовиты моно- и тетразамещённые станнаны RSnX3 и R4Sn, но особенно — тризамещённые R3SnX: они блокируют энергообмен в живой клетке. А вот механизм токсического действия дизамещённых станнанов пока не выяснен. Именно токсические свойства тризамещенных станнанов оказались наиболее востребованы. Производные трибутилолова используются как высокоэффективные дезинфицирующие средства.
Кремний и углерод — близкие родственники. Многие соединения кремния имеют углеродные аналоги, а сам он, как и углерод, может образовывать цепочки атомов. Неслучайно поэтому в научной фантастике встречаются рассуждения на тему «кремниевых» миров — биологических систем, в которых роль углерода в построении молекул играет кремний.
Однако вероятность существования кремниевых организмов даже в дальнем космосе крайне мала. Пока не удалось построить кремниевый аналог хоть сколько-нибудь сложной биологический молекулы. К концу XX в. получены соединения, содержащие кремниевые цепочки длиной до пяти атомов. И если гексаметилдисилан (CH3)3Si—Si(CH3).. достаточно устойчив, то уже производное трисилана (CH3)3Si—Si(CH3)2—Si(CH3)3легко окисляется на воздухе. А соединения, содержащие цепочки из четырёх или пяти атомов кремния, на воздухе самовоспламеняются. Синтезирован только один аналог алкенов — тетрамезитилдисилен; в нём атомы кремния со всех сторон «прикрыты» триметилбензольными (мезитиленовыми) кольцами.
Кремниевые аналоги алкинов и более сложных органических молекул получить пока не удалось.
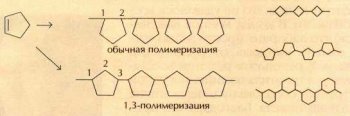
Во-вторых, подобные полимеры обладают исключительной термостойкостью. Полициклопентен плавится при 395 °С, полициклобутен — при 485 °С, а полициклогексен — при 600 °С, что сопоставимо с температурой размягчения оконного стекла.
Не много можно найти органических соединений, которые бы не разлагались при такой температуре.
Долгое время алюминийорганические соединения, впервые полученные в 1865 г. Дж. Бактоном и У. Одлингом при нагревании алюминия с диалкилртутью, не представляли хоть сколько-нибудь заметного практического интереса. Ситуация коренным образом изменилась в начале 50-х гг. XX в., когда были открыты алюминийорганические катализаторы полимеризации олефинов.
Достаточно давно было известно, что триэтилалюминий реагирует с этиленом. При этом молекула этилена внедряется в связь алюминий-утлерод:
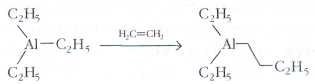
Однако для получения полимера такая реакция не годится — идёт медленно, да и цепочки получаются коротенькие.
С другой стороны, ртутьорганические соединения вступают в реакции, необычные и интересные с точки зрения органической химии. Если в молекуле органического вещества есть связь С=С, то атом ртути легко образует с ней комплекс. Это значительно облегчает различные реакции присоединения к двойной углерод-углеродной связи. Данное свойство было использовано русским химиком Михаилом Григорьевичем Кучеровым (1850—1911) для присоединения воды к ацетиленам.
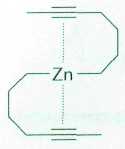
Реальная химия элементоорганических соединений началась с цинкорганических соединений, которые оказались весьма полезными, например для надёжного, достаточно хорошо воспроизводимого и предсказуемого метода синтеза спиртов. Так, при работе над теорией химического строения Бутлерову потребовалось соединение, содержащее четвертичный атом углерода. В то время подобные соединения не были изучены. Взаимодействие ацетона с диметилцинком привело к желаемому третичному бутанолу (СН3)3СОН. Правда, впоследствии оказалось, что такие реакции проходят с большими выходами, если цинк заменить на магний.
Пример цинкорганического соединения.