В XIX в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняют способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории) связи оказываются не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3KF•AlF3), другие — аммиакатами (CuSO4•4NH3 третьи — кристаллогидратами (CuСl2•6Н2О) и т. д.
Необычность поведения подобных веществ можно продемонстрировать на примере соединений «четырёхвалентной» платины: PtCl4•2NH3, PtCl4•4NH3, PtCl4•6NH3 и PtCl4•2KCl. Несмотря на внешнее сходство, они резко различаются по свойствам. Так, первое из них в растворе практически не распадается на ионы (раствор не проводит электрический ток). Отсутствие хлорид-ионов подтверждает и качественная реакция: при взаимодействии раствора с нитратом серебра осадка AgCl не выпадает.
В начале XVIII в. красильный мастер Дисбах в Берлине приобрёл у торговца необычный поташ (карбонат калия), растворы которого с солями железа давали синее окрашивание. Оказалось, что поташ был ранее прокалён с бычьей кровью. Так открыли новую краску, названную берлинской лазурью. Но лишь гораздо позднее стало понятно, какие же химические процессы приводят к её образованию. Животные остатки, в том числе и кровь, содержат азот и серу. Карбонат калия прокаливали с сухой кровью в больших чугунных сосудах, в которые специально добавляли железные опилки или стружки. В этих условиях карбонат частично превращается в цианид KCN, а сера даёт с железом сульфид FeS. При обработке смеси горячей водой идёт реакция 6KCN + + FeS=K4[Fe(CN)6]+K2S. Её продукты — сульфид калия и соединение, которое в своё время назвали жёлтой кровяной солью (химическое название — гексацианоферрат(П) калия). А слово «цианид» происходит от греческого «кианос» — лазурный.
При взаимодействии жёлтой кровяной соли с солями железа(III) и образуется берлинская лазурь. Состав растворимой формы краски отвечает формуле K[Fe3+Fe2+(CN)6], а нерастворимой — Fe4[Fe(CN)6]3.
С—Н-кислотами называют органические вещества, в которых атомы водорода, связанные с атомом углерода, способны замешаться на металл. Например, заметные «кислотные» свойства проявляют углеводороды с тройной связью — ацетилен (С2Н2) и его производные. Так, ацетилен взаимодействует с металлическим натрием с образованием белого порошка аиетиленида натрия:
2СН=СН+2Na®2Н—СºС—Na+Н2.
Ещё более сильной С—Н-кислотой является трифенилметан (С6Н5)3СН — он реагирует даже с водным раствором щёлочи. Самая сильная из известных С—Н-кислот — цианпроизводное фуллерена: это примерно в 100 раз более сильная кислота, чем уксусная.
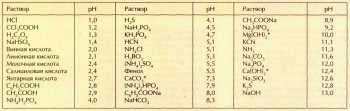
Интересно сравнить кислотность (щёлочность) растворов различных кислот, оснований и солей. Значение рН зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Получается, что если выпить концентрированный лимонный сок, кислотность желудочного сока... понизится! Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Для характеристики кислотности среды вводят водородный показатель рН, который равен взятому с обратным знаком десятичному логарифму молярной концентрации ионов водорода: pH=-lg[H+].
В зависимости от концентрации ионов Н+ в растворе может быть кислая, нейтральная или щелочная среда. Дистиллированную воду, взятую при температуре 22 °С, принято считать нейтральной. Являясь слабым электролитом, вода частично диссоциирует на ионы Н+ (в водных растворах он всегда гидратирован и присутствует в виде Н3О+) и ОН-. Их концентрации одинаковы и составляют при комнатной температуре 10-7 моль/л.
Несложно рассчитать, что для нейтрального раствора (дистиллированной воды) рН=-lg(10-7)=7. Если значение водородного показателя меньше 7, раствор является кислым, так как концентрация ионов водорода в нём выше концентрации гидроксид-ионов. Например, раствор соляной кислоты с концентрацией 1 моль/л имеет pH=-lg(1)=0.
Каждому школьнику хорошо знаком лакмус — с его помощью определяют кислотность среды. Это вещество является кислотно-основным индикатором, т. е. обладает способностью обратимо изменять окраску в зависимости от кислотности раствора: в кислой среде лакмус становится красным, а в щелочной — синим. В нейтральной среде цвет лакмуса фиолетовый — это сочетание равных количеств синего и красного. Хотя лакмус уже в течение нескольких столетий верно служит людям, его состав так до конца и не изучен. В этом нет ничего удивительного: ведь лакмус — это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски — заменителя дорогостоящего пурпура. Затем рецепт приготовления лакмуса оказался утерян. Лишь в начале XIV в. во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.
Для количественной характеристики способности электролита распадаться на ионы введено понятие степени диссоциации (a), т. е. отношения числа молекул, распавшихся на ионы, к общему числу молекул. Например, a=1 говорит о том, что электролит полностью распался на ионы, а a=0,2 означает, что продиссоциировала лишь каждая пятая из его молекул. При разбавлении концентрированного раствора, а также при нагревании его электропроводность повышается, так как возрастает степень диссоциации.
В зависимости от величины а электролиты условно делятся на сильные (диссоциируют практически нацело, a>0,95), средней силы (0,95 >a>0,3) и слабые (a<0,3). Cuльными электролитами являются многие минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.), щёлочи (NaOH, КОН, Са(ОН)2 и др.), почти все соли. К слабым принадлежат растворы некоторых минеральных кислот (H2S, H2SO3, H2CO3, HCN, HClO), многие органические кислоты (например, уксусная СН3СООН), водный раствор аммиака (NH3•nН2О), вода, некоторые соли ртути (HgCl2). К электролитам средней силы часто относят плавиковую HF, ортофосфорную Н3РО4 и азотистую HNO2 кислоты.
В теории, разработанной американским физикохимиком Гилбертом Ньютоном Льюисом (1875—1946), кислотно-основные свойства частиц определяются, исходя из их электронного строения. Кислота, по Льюису, — это вещество, являющееся акцептором электронной пары, а основание — донором электронной пары. Так, в реакции образования иона аммония молекула аммиака служит основанием, а ион водорода — кислотой:
N••H3+Н+®NH+4
Теория Льюиса позволяет включить в число кислот и оснований вещества, не содержащие водорода. Например, бромид железа(Ш) является кислотой Льюиса, поскольку атом железа выступает акцептором (у него есть вакантные орбитали), а бромид-ион — основанием Льюиса (у него имеются электронные пары). Кислота и основание Льюиса реагируют друг с другом:
FeBr3+Br-= FeBr4-.
Понятия кислоты и основания, сформулированные Аррениусом, получили развитие в трудах других учёных. В 1923 г. датский физикохимик Иоханнес Николаус Брёнстед (1879—1947) и английский химик Томас Лоури (1874—1936) выдвинули протолитическую теорию, согласно которой кислотой является частица, отдающая протон (донор Н+). Основание в таком случае — частица, принимающая протон (акцептор Н+). Реакция между кислотой и основанием заключается в переносе протона от кислоты к основанию. Эти представления позволили расширить понятия кислоты и основания, распространив их также и на отдельные ионы. Например, аммиак в водном растворе является основанием, а вода — кислотой:
NH3+H2O«NH4++OH-. основание кислота кислота основание
В результате взаимодействия кислоты с основанием образуются новая кислота и новое основание. Как правило, такие реакции являются обратимыми, а положение равновесия смещено в сторону образования наиболее слабой кислоты и наиболее слабого основания (в приведённом примере — влево).
Некоторые ионы настолько прочно удерживают гидратную воду, что кристаллизуются из раствора в виде кристаллогидратов. Таким веществом, например, является медный купорос — пятиводный сульфат меди CuSO4•5Н2О. Интересно, что непосредственно с атомом меди связаны лишь четыре молекулы воды, а пятая находится в пустотах кристаллической решётки. При нагревании синие кристаллы медного купороса отщепляют воду, превращаясь в серый порошок — безводный сульфат меди. А если он попадёт в воду, произойдёт обратный процесс — гидратация, сопровождающаяся выделением тепла. Этот простой опыт показывает, что окраска медного купороса вызвана именно гидратированными ионами мели.
Безводный сульфат меди CuSO4 бесцветный (слева), но при соприкосновении с водой он мгновенно превращается в медный купорос CuSO4•5Н2О (справа).
Новый этап в развитии представлений о кислотах и основаниях связан с созданием теории электролитической диссоциации, разработанной в 1887 г. С. Аррениусом. Согласно этой теории, кислоты, основания и соли в водных растворах диссоциируют (от лат. dissociatio — «разлагаю»), т. е. распадаются на ионы, благодаря чему раствор становится электропроводным. Такие вещества были названы электролитами (от греч. «литос» — «растворённый»). Однако не все электролиты в водных растворах существуют исключительно в виде ионов. Так, например, в растворах уксусной кислоты количество недиссоциированных молекул во много раз превышает число молекул, которые распались на ионы.
С позиции теории Аррениуса кислотой называют электролит, диссоциирующий в водном растворе с образованием катионов лишь одного типа — ионов водорода. Аналогично, основание — это электролит, образующий при диссоциации лишь один тип анионов — гидроксид-ионы. (Более подробно о теории Аррениуса см. статью «Его Величество Раствор».)
Марка, выпушенная в Швеции в честь открытия явления электролитической диссоциации.
Сейчас грамотному химику не придёт в голову пробовать на вкус вещества, с которыми он работает, хотя в прошлом вкус являлся обязательной характеристикой при описании каждого соединения. Первоначально под кислотой понимали вещество, раствор которого имеет кислый вкус.
Главные минеральные кислоты — соляная, серная и азотная — были получены ещё алхимиками. Постепенно накапливались факты, свидетельствующие об общих свойствах кислот, например об их способности разрушать металлы. А. Л. Лавуазье попытался объяснить свойства кислот наличием в них кислорода. Однако кислородная теория кислот сдала свои позиции после того, как был доказан состав соляной кислоты: она кислорода не содержит. В итоге кислородная теория сменилась водородной, которую разработали Г. Дэви и Ю. Либих. Согласно ей, кислотами являются вещества, содержащие атомы водорода, способные замещаться на металл.