В теории, разработанной американским физикохимиком Гилбертом Ньютоном Льюисом (1875—1946), кислотно-основные свойства частиц определяются, исходя из их электронного строения. Кислота, по Льюису, — это вещество, являющееся акцептором электронной пары, а основание — донором электронной пары. Так, в реакции образования иона аммония молекула аммиака служит основанием, а ион водорода — кислотой:
N••H3+Н+®NH+4
Теория Льюиса позволяет включить в число кислот и оснований вещества, не содержащие водорода. Например, бромид железа(Ш) является кислотой Льюиса, поскольку атом железа выступает акцептором (у него есть вакантные орбитали), а бромид-ион — основанием Льюиса (у него имеются электронные пары). Кислота и основание Льюиса реагируют друг с другом:
FeBr3+Br-= FeBr4-.
Cuльную кислоту Льюиса представляет собой фторид сурьмы (V) SbF5 — бесцветная вязкая жидкость, разлагающаяся водой. При растворении её в безводной фторсульфоновой кислоте HSO3F льюисова кислотность раствора повышается настолько, что полученную смесь называют магической кислотой.
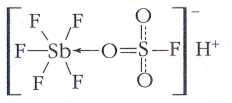
Своим названием данное соединение обязано молодому немецкому химику И. Лукасу, который работал в группе известного химика Георга Ола,
нобелевского лауреата 1994 г, Во время рождественских праздников один из членов группы шутки ради бросил в эту «адскую смесь» восковую свечу, которая немедленно растворилась. «Да это же магическая кислота!» — воскликнул поражённый Лукас. С тех пор термин не только стал общепринятым у химиков, он официально зарегистрирован как торговая марка. Магическая кислота в 1015 раз более «кислая», чем концентрированная серная.
Ещё большей кислотности можно добиться, добавив в магическую кислоту серный ангидрид SO3. Все эти смеси являются сверхкислотами — наиболее сильными из известных ныне доноров протонов. В растворах сверхкислот свойства оснований проявляют даже такие инертные вещества, как углеводороды. Например, в магической кислоте неопентан (2,2-диметилпропан) присоединяет ион водорода, превращаясь в метан и катион третичного бутила:
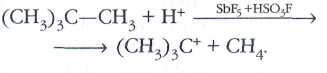
Похожие статьи