Каждому школьнику хорошо знаком лакмус — с его помощью определяют кислотность среды. Это вещество является кислотно-основным индикатором, т. е. обладает способностью обратимо изменять окраску в зависимости от кислотности раствора: в кислой среде лакмус становится красным, а в щелочной — синим. В нейтральной среде цвет лакмуса фиолетовый — это сочетание равных количеств синего и красного. Хотя лакмус уже в течение нескольких столетий верно служит людям, его состав так до конца и не изучен. В этом нет ничего удивительного: ведь лакмус — это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски — заменителя дорогостоящего пурпура. Затем рецепт приготовления лакмуса оказался утерян. Лишь в начале XIV в. во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.

При переходе от кислой среды к щелочной окраска лакмуса меняется с красной на синюю.
Готовили лакмус из специальных видов лишайников. Измельчённые лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную таким образом густую массу помешали в деревянные бочки, добавляли мочу и выдерживали длительное время. Постепенно раствор приобретал тёмно-синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей. В XVII столетии производство орсейли было налажено во Фландрии и Голландии, а в качестве сырья использовали лишайники, которые привозили с Канарских островов.
Похожее на орсейль красящее вещество было выделено в XVII в. из гелиотропа — душистого садового растения с тёмно-лиловыми цветками.
Знаменитый физик и химик XVII в. Роберт Бойль писал о гелиотропе: «Плоды этого растения дают сок, который при нанесении на бумагу или материю имеет сначала свежий ярко-зелёный цвет, но неожиданно изменяет его на пурпурный. Если материал замочить в воде и отжать, вода окрашивается в винный цвет; такие виды красителя (их обычно называют «турнесоль») есть у аптекарей, в бакалейных лавках и в других местах, которые служат для окраски желе, или других веществ, кто как хочет». С того времени орсейль и гелиотроп стали использовать в химических лабораториях. И лишь в 1 704 г. немецкий учёный М. Валентин назвал эту краску лакмусом.
Сегодня для производства лакмуса измельчённые лишайники сбраживают в растворах поташа (карбоната калия) и аммиака, затем в полученную смесь добавляют мел или гипс. Считается, что красящими веществами лакмуса являются индофенолы, которые в кислой среде существуют в катионной форме, а в щелочной — в анионной, например:
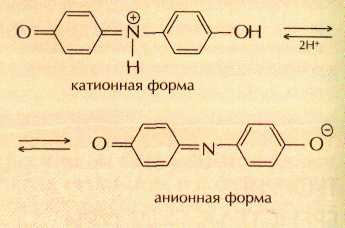
В некоторых странах краску, сходную с лакмусом, добывали и из других растений. Простейшим примером служит свекольный сок, который также изменяет цвет в зависимости от кислотности среды.

В сильнокислой среде индикатор метиловый оранжевый имеет красную окраску, в слабокислой и нейтральной — оранжевую, а в щелочной — жёлтую.
Метиловый оранжевый в щелочной среде.
В XIX в. на смену лакмусу пришли более прочные и дешёвые синтетические красители, поэтому использование лакмуса ограничивается лишь грубым определением кислотности среды. Для этой цели служат полоски фильтровальной бумаги, пропитанные раствором лакмуса. В аналитической практике применение лакмуса ограничено тем, что по мере полкисления он изменяет окраску постепенно, а не в узком интервале рН, как многие современные индикаторы. На смену лакмусу в аналитической химии пришёл лакмоид — краситель резорциновый синий, который отличается от природного лакмуса по строению, но сходен с ним по окраске: в кислой среде он красный, а в щелочной — синий.

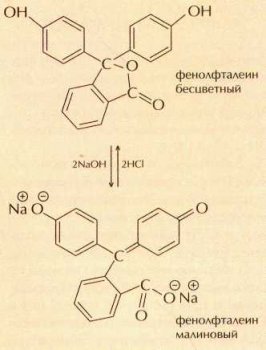
При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины XIX в. С некоторыми из них можно познакомиться в школьной химической лаборатории. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной — оранжевый, а в щелочной — жёлтый. Более яркая цветовая гамма свойственна индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной — жёлтый, а в щелочной — синий. Индикатор фенолфталеин (он продаётся в аптеке под названием «пурген») в кислой и нейтральной среде бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зелёный (сто спиртовой раствор используется как дезинфицирующее средство — «зелёнка»). Для того чтобы проверить это, надо приготовить разбавленный раствор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптечного препарата. Раствор приобретёт красивый зелёно-голубой цвет. В сильнокислой среде его окраска сменится жёлтой, а в сильнощелочной раствор обесцветится.
Однако наиболее часто в лабораторной практике используется универсальный индикатор — смесь нескольких кислотно-основных индикаторов. Он позволяет легко определить не только характер среды (кислая, нейтральная, щелочная), но и значение кислотности (рН) раствора.

Индикатор тимоловый синий в кислой среде имеет малиново-красную, в нейтральной — жёлтую, а в щелочной — синюю окраску
Похожие статьи