Олово.
Олово наряду со свинцом, железом, золотом, ртутью, медью, серебром входит в число «семи металлов древности». Оно известно человечеству по крайней мере с середины III тысячелетия до н. э. Люди обнаружили, что добавка к меди 5—10% олова повышает её прочность и несколько снижает температуру плавления: чистая медь плавится при 1083 °С, а медь, содержащая 10 % олова, — при 1005 °С. В природе олово встречается в виде минерала касситерита (от греч. «касситерос» — «олово») SnO2, месторождения которого довольно редки: в древности его добывали лишь в Испании, на Кавказе и в Китае. Как свидетельствует гомеровский эпос, олово ценилось ещё во времена Троянской войны. Плиний Старший в «Естественной истории» рассказывает, что «белый свинец» (так он называет олово) «...рождается в Луситании и в Каллекии (римских провинциях на Пиренейском полуострове. — Прим. ред.), на поверхности земли, песчаной и чёрного цвета... Горняки промывают эти пески и то, что оседает, плавят в печах...». При прокаливании смеси касситерита с углём олово, благодаря низкой температуре плавления (232 °С), легко отделялось. Так получают его и в наши дни.
Германий относится к числу элементов, которые сначала были предсказаны Д. И. Менделеевым и лишь затем открыты. Менделеев поместил элемент, названный им экасилицием, в подгруппу углерода.
В 1885 г. австрийский химик Карл Ауэр фон Вельсбах (1858—1929), изучая состав нового минерала серебра, обнаружил, что в нём содержится около 7% какого-то неизвестного элемента. Вскоре немецкому учёному Клеменсу Александру Винклеру (1838—1904) удалось выделить его в виде простого вещества. Он назвал элемент германием (Germanium) в честь своей родины.
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °С до простого вещества: GeO2+2Н2=Ge+2Н2О.
Обычное оконное стекло — это силикат состава Na2O•СаО•6SiO2. Стекло — аморфный материал, представляющий собой переохлаждённую жидкость. Иногда в стекле возникают области кристаллизации, что приводит к потере прочности. Получают стекло сплавлением кварцевого песка SiO2, известняка СаСО3 и соды Na2CO3:
Na2CO3+CaCO3+6SiO2= Na2O•СаО•6SiO2+2СО2.
Процесс осуществляют в печах при температуре 1100—1600 °С, после чего образовавшуюся стекломассу постепенно охлаждают.
Окрашенные стёкла получают введением в шихту (смесь исходных материалов) различных оксидов: NiO придаёт стеклу разнообразную цветовую гамму — от фиолетовой до жёлтой и серо-коричневой, Сr2О3 сообщает ему травянисто-зелёную окраску, CuО или СоО — синюю, оксиды железа — от голубовато-зелёной (FeO) до красно-бурой (Fe2O3), Mn2O3 — фиолетовую или пурпурную, Cu2O — красную, Sb2O3 —
жёлтую, U3O8 — желтовато-зелёную (урановое стекло), коллоидные растворы меди и золота — рубиново-красную («медный рубин» и «золотой рубин»). Молочное стекло образуется при введении в шихту порошка полевого и плавикового шпатов.
Если в крепкий раствор силиката натрия Na2SiO3 опустить кристаллы солей железа, меди, кобальта, никеля, марганца, кальция, алюминия, то через некоторое время в стакане вырастет... разноцветный «сад»! Можно заметить, как от упавшего на дно стакана кристаллика соли отрывается пузырёк воздуха, который, поднимаясь к поверхности, как бы вытягивает из кристалла тончайшую полую внутри трубку-мембрану, состоящую из плёнки кремниевой кислоты и гидроксида металла. «Сад» растёт благодаря тому, что концентрация раствора Na2SiO3 внутри каждой такой трубки значительно ниже, чем за её пределами. Это своеобразный пример осмоса — самопроизвольного перехода молекул растворителя через полупроницаемую мембрану. Быстрее всего «прорастают» соли трёхзарядных катионов — железа и алюминия:
2FeCl3+2Na2SiO3+3H2O=2Fe(OH)3¯+3H2SiO3¯+6NaCl
Керамикой (от греч. keramos — «глина») называют изделия из глины, закреплённые обжигом. К видам керамики относят гончарные изделия, терракоту, майолику, фаянс, фарфор и каменную массу.
Майоликой называют тяжёлые, крупнопористые керамические изделия, покрытые непрозрачной эмалью. Благодаря обжигу при сравнительно невысокой температуре изделия из майолики сохраняют красивые яркие краски. Расцвет этой техники пришёлся на XV—XVII вв., позже её вытеснили фаянс и фарфор.
Фарфор — это керамические изделия, выполненные из смеси белой глины с полевым шпатом и кварцем, подвергнутые высокотемпературному обжигу и отличающиеся непористым строением. Сформованное изделие доводят до начала спекания, что делает его влагонепроницаемым. С химической точки зрения фарфор представляет собой стекловидную алюмосиликатную массу с включениями кристаллов муллита ЗAl2О3•2SiO2 и зёрен кварца. Предметы из тонкого фарфора просвечивают. Обычно их покрывают сверху глазурью и подвергают повторному обжигу.
Кристаллический кремний.
Кварц, горный хрусталь, аметист, халцедон, топаз, оникс... Трудно поверить, но все эти и многие другие «чудеса подземного мира» состоят из одного и того же вещества — кремнезёма, или оксида кремния(IV) SiO2. Предположения о том, что в кремнезёме содержится новый, ещё неизвестный элемент, высказывались учёными уже в XVIII столетии. Однако в виде простого вещества кремний был выделен лишь в XIX в. Й. Я. Берцелиусом. Вначале он нагревал смесь кремнезёма с порошком железа и углём до 1500 °С, но чистый кремний получить не удавалось: в присутствии железа образуется ферросилиций — сплав, содержащий оба эти элемента. Поняв, в чём ошибка, Берцелиус изменил способ синтеза. В 1823 г., когда он пропустил над калием пары фторида кремния(IV), удача наконец улыбнулась ему. По реакции SiF4+4К=Si+4KF был получен порошок аморфного кремния. Берцелиус доказал таже, что, сгорая на воздухе, кремний переходит в кремнезём.
На основе графита в наши дни производится множество различных материалов. Наиболее известен графлекс (от англ. flexible graphite — «гибкий графит»), или пенографит. Для его получения порошок графита пропитывают азотной кислотой, а затем быстро нагревают в восстановительной среде. При этом происходит разложение азотной кислоты, и под давлением образующихся газов слои графита расщепляются и разрываются на хлопья. Получившийся высокопористый материал проходит прокатку и штамповку. Графлекс не подвержен коррозии и применяется в качестве уплотнителя там, где из-за действия высокой температуры нельзя использовать резину или металлы.
Стеклоуглерод — продукт пиролиза (нагревания без доступа воздуха до температуры 800 °С) феноло-формальдегидных смол. Этот материал химически стоек к действию кислот и щелочей. Выполненная из него посуда по многим свойствам не уступает платиновой.
Усилия многих учёных — физиков, химиков, материаловедов — направлены на развитие нанотехнологии — технологических процессов, осуществляемых на молекулярном уровне. Греческая приставка «нано-» означает одну миллиардную часть, т. е. 10-9 (например, 1 нм = 10-9 м).
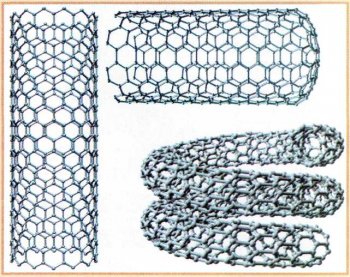
В 1991 г. японские учёные на стенках прибора, в котором проводили синтез фуллеренов, обнаружили наночастицы углерода — полые углеродные трубки диаметром 3—1 0 нм, их стенки состоят всего из нескольких слоёв атомов. С одной стороны каждая такая трубка закрывается «крышкой», которая является не чем иным, как фрагментом структуры фуллерена. Существуют и однослойные нанотрубки — их диаметр всего 0,9 нм. Специалисты предполагают, что нанотрубки, подобно графиту, должны хорошо проводить электрический ток, а возможно, и являться сверхпроводниками. Изучение этих интересных объектов только начинается.
Нанотрубки.
На основе фуллеренов получены полимерные материалы; разрабатываются методы синтеза металлофуллеренов — соединений, содержащих в центре оболочки из атомов углерода атомы металлов (например, лантанидов). Фторированные фуллерены (в частности, C60F48) способны служить катодом в литиевых гальванических элементах, где электрический ток возникает в результате реакции C60F48+xLi=Cb0F48-x+xLiF. Появилась возможность разработки на основе фуллеренов запоминающих устройств со сверхвысокой плотностью информации. Это позволит поместить на один диск огромное количество данных. С использованием фуллеренов предполагается создавать сверхпроводящие материалы, лекарства с противоопухолевой активностью, фотоприёмники, красители.
Графит — наиболее устойчивая при комнатной температуре аллотропная модификация углерода. Теоретически все алмазы должны были уже давно превратиться в графит, но с заметной скоростью такая реакция идёт лишь начиная с температуры около 1000 °С, а при 2000 °С она происходит почти мгновенно. Однако с практической точки зрения гораздо больший интерес представляет обратный процесс — превращение графита в алмаз. Это становится возможным при температуре около 3000 °С и давлении 3•106 атм. К сожалению, алмазы, которые удаётся получить из графита, обычно очень мелкие и невысокого качества. Они могут быть использованы лишь для технических целей.
В XVII—XVIII вв., в период расцвета теории флогистона, считали, что уголь полностью состоит из этого таинственного вещества: ведь при горении угля почти не образуется твёрдого остатка. И только A. JI. Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь — всего лишь простое вещество. Лавуазье назвал новый элемент Carboneum вместо старого латинского названия car-bone pur — «чистый уголь», которым долгое время пользовались химики.
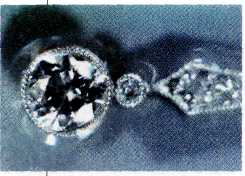
Алмаз является одним из самых твёрдых и тугоплавких (tпл>4000 °С) веществ. В то же время алмаз хрупок: его довольно легко расколоть на части. Аля этого ювелиры пользуются ножом, по которому ударяют молотком. Немногие знают, что алмаз обладает очень высокой теплопроводностью — проводит тепло лучше, чем многие металлы (в 4 раза лучше Cu). В то же время он не проводит электрический ток.