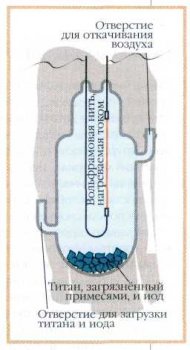
Современные наука и техника нередко нуждаются в сверхвысоком вакууме, который не могут создать обычные ртутные насосы. И тут выручает титан, обладающий способностью прочно связываться с основными компонентами воздуха. В камере титан реагирует с содержащимся в воздухе кислородом и азотом, связывая их в оксид TiO2 и нитрид TiNx (где 0,58<х<1,00), что и создаёт сверхвысокий вакуум,
Это же свойство титана используют для удаления кислорода и азота из стали с целью повышения её качества. Но особенно перспективным оказалось применение тонких покрытий из нитрила титана — одного из самых прочных химических соединений. Используя современные технологии (в том числе лазерные), вещество наносят слоем толщиной всего 2— 3 мкм на поверхность, которую надо сделать твёрдой и износоустойчивой. Покрытые нитридом титана инструменты из быстрорежущей стали (резцы, свёрла, фрезы) и служат дольше, и повышают производительность труда. А выглядят они точь-в-точь как позолоченные — ведь цвет нитрида титана почти такой же, как и у золота.
Нитридные покрытия используются всё шире, например для зубных коронок, «золочения» куполов. Так, купола храма Христа Спасителя в Москве почти полностью покрыты нитридом титана, который отличается чуть более красноватым цветом в сравнении с находящимися неподалёку позолоченными куполами кремлёвских соборов.
Храм Христа Спасителя. Москва.
Титан входит в десятку самых распространённых элементов земной коры, в почвах и горных породах его обычно от 0,5 до 1,5%. Однако некоторые местности особенно богаты титаном. Так, на острове Святой Елены, «где угасал Наполеон», содержание этого элемента достигает 2,5%. Самые же богатые титаном почвы — краснозёмы двух островов Западного Самоа в Тихом океане: в них титана до 12%! Будь этот регион поближе к промышленно развитым странам, вероятно, открытие столь распространённого элемента состоялось бы намного раньше.
По сравнению с другими часто встречающимися металлами титан дороже, поскольку его очень сложно извлекать из руд: он исключительно прочно связан с кислородом.
Как и все наиболее распространённые элементы, титан неизбежно присутствует в живых организмах. У взрослого человека в селезёнке, надпочечниках и щитовидной железе содержится примерно 20 мг Ti. Однако его роль в точности пока не выяснена. Твёрдо установлено, что этот элемент совершенно неядовит. В медицинской литературе описан случай, когда человек съел почти полкилограмма TiO2 — и никаких последствий. Из этого количества диоксида титана можно было бы приготовить целую банку первоклассных белил.
Ещё в начале XX в. никто не предполагал, что через каких-нибудь 30—50 лег малоизвестный металл титан войдёт в число самых важных конструкционных материалов и сплавов, используемых в современной технике. Однако всё по порядку. Хотя минералы титана — рутил TiO2 и ильменит FeTiO3 широко распространены в природе, этот элемент долгие годы оказывался «в тени», его соединения не являлись предметом специальных
исследований. Лишь в 1795 г. известный немецкий химик Мартин Клапрот выделил титан из рутила. Новооткрытый элемент был назван в честь титанов — сыновей Урана (Неба) и Геи (Земли), низверженных Зевсом в царство тьмы. В 1910 г. металлический титан чистотой 99 % удалось получить американскому исследователю Майклу Хантеру при восстановлении тетрахлорида титана металлическим натрием:
TiCl4+4Na®850 °С Ti+4NaCl.
Все элементы VIIIA группы представляют собой одноатомные газы, которые только при очень низких температурах могут быть переведены в жидкое и твёрдое состояние.
Интересно, что температуры кипения и плавления каждого газа различаются всего лишь на несколько градусов. Это объясняется слабым межмолекулярным взаимодействием как в жидкой, так и в твёрдой фазе.
Гелий обладает самой низкой температурой кипения и плавления. Перевести его в твёрдое состояние удаётся только при давлении порядка 25•105Па.
Жидкий гелий впервые получил в 1908 г. нидерландский физик Хейке Камерлинг-Оннес, удостоенный за это Нобелевской премии (1913 г.).
В 1938 г. выдающийся советский физик Пётр Леонидович Капица (1894—1984) установил, что при температурах ниже 2,17 К (-271 °С) жидкий гелий не обладает вязкостью, т. е. становится сверхтекучим. В таком состоянии теплопроводность гелия в миллион раз больше, чем при 4 К (-269 °С). За открытие и исследование этого явления учёному в 1978 г. была присуждена Нобелевская премия, а в 1962 г. Нобелевскую премию получил Лев Давидович Ландау, давший теоретическое обоснование явления сверхтекучести. Сверхтекучесть жидкого гелия позволит использовать его в будущем для создания сверхпроводящих электромагнитов.
Долгое время считалось, что инертные газы не вступают в химические реакции. Однако в 1962 г. канадский химик Нил Бартлетт при нагревании смеси ксенона с сильным окислителем — гексафторидом платины PtF6 получил жёлтое кристаллическое вещество состава XePtF6.
После публикации результатов Бартлетта за один год удалось синтезировать фториды ксенона — XeF2,
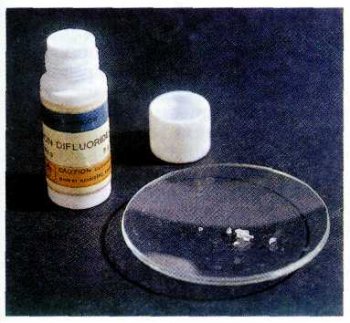
Кристаллы XeF2. Это вещество получают нагреванием смеси ксенона с фтором при 400 °C. Хранят дифторид ксенона в тефлоновых контейнерах.
XeF4, XeF6 — и исследовать их строение и свойства.
К концу XX столетия число полученных соединений ксенона превысило сотню, соединений криптона — уже более двух десятков, среди них KrF2, KrF4, соли криптоновой кислоты Н2KClO4. Самым химически активным должен быть радон, но он слишком нестабилен, и синтезировано всего несколько сто соединений. Теперь очередь за аргоном. Для него пока известны только соединения включения, например клатрат Ar•6Н2О (гидрат аргона), где аргон не образует химической связи, а включён в кристаллическую решётку льда.
Что же касается гелия и неона, то они, надо полагать, навсегда останутся непоколебимыми в своём «благородстве».
После открытия инертных газов и создания «нулевой группы» периодическая система элементов приобрела более законченный вид.
С развитием представлений об электронном строении атомов стало ясно, что инертные газы имеют целиком заполненные s- и р-подуровни. На единственном электронном уровне атома гелия располагаются два электрона (1s2), а остальные представители группы являются p-элементами, и у них на внешнем электронном уровне находятся по восемь электронов (ns2np6 где n — номер периода). Поэтому с точки зрения электронного строения неон и более тяжёлые газы следует поместить в главную подгруппу VIII группы. Гелий можно было бы отнести к s-элементам и формально поставить в группу IIА Однако он настолько непохож по свойствам на элементы II группы: бериллий, магний и другие, что его оставили в VIII группе вместе с подобными ему газами.
Все электроны в атомах гелия, неона и аргона очень прочно связаны с ядром, поэтому эти элементы не вступают в химические реакции. Энергия же р-орбиталей криптона, ксенона и радона позволяет им быть донорами р-электронов при образовании химических связей с наиболее электроотрицательными элементами — фтором, кислородом. Недаром учёные отказались от прежнего названия «инертные» и сейчас именуют эту подгруппу благородными газами.
После открытия фторидов ксенона были получены и другие соединения этого элемента, в том числе оксиды, кислоты и их соли. Однако фториды оказались наиболее устойчивыми, и их свойства удалось детально изучить.
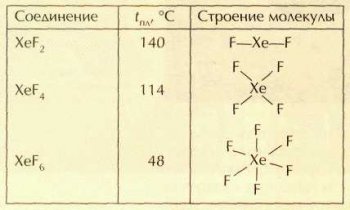
Известно три фторида ксенона: XeF2, XeF4, XeF6. Все они представляют собой легкоплавкие бесцветные кристаллические вещества с характерным запахом, состоящие из молекул.
Фториды ксенона являются энергичными окислителями. Фторид ксенона(П), например, активно окисляет воду: 2XeF2+ 2Н2О = 2Хе0 + О02+4HF, переводит Cl- в Cl2, Мn2+ в MnO-4.
История открытия благородных газов драматична и могла бы послужить основой для хорошего химического детектива. А началась она довольно банально. Английский физик Джон Уильям Рэлей не предполагал совершить никакого открытия. Опытный, педантичного склада экспериментатор, он в 1888 г. решил определить плотности и молекулярные массы различных газов с очень высокой для того времени степенью точности — до сотых долей процента. Однако азот, выделенный им из воздуха, неизменно оказывался тяжелее, чем полученный при разложении нитрита аммония. Литр азота воздуха имел массу 1,2572 г, а литр «химического» азота — 1,2505 г. Разница невелика, но она выходила за пределы экспериментальной погрешности и была постоянной. Сам Рэлей не сумел объяснить этот парадокс.
Через научный журнал «Nature» («Природа») Рэлей в апреле 1894 г. обратился к учёным с просьбой помочь в решении проблемы. Откликнулся только один человек — заведующий кафедрой химии Лондонского университета Уильям Рамзай (1852— 1916). Он высказал неожиданную идею: вероятно, в азоте, выделенном из воздуха, есть небольшая примесь какого-то другого, более тяжёлого газа. Мысль была смелая, даже дерзкая — ведь до этого состав воздуха изучали сотни исследователей.
Хлорная кислота НСlО4 является самой сильной из известных кислот. Можно было бы ожидать, что она окажется и сильным окислителем: ведь хлор в хлорной кислоте находится в высшей степени окисления (+7). Однако её окислительные свойства заметно ниже по сравнению с другими кислотами-окислителями — серной и азотной.
Так, водные растворы хлорной кислоты не восстанавливаются иодидом калия, а концентрированная хлорная кислота реагирует с магнием с выделением... водорода!
Mg+2НСl+7О4=Mg(Cl+7O4)2+Н2
Разработанная ещё в XVII столетии техника травления стекла плавиковой кислотой широко применялась в мастерских европейских стран на рубеже XIX—XX вв. Особенно прославился французский мастер Эмиль Галле (1846—1904), создававший непрозрачные стеклянные вазы с многослойными узорами. По нанесённому рисунку он аккуратно вытравливал один, два или три слоя стекла, тем самым придавая каждому фрагменту композиции свой неповторимый цветовой оттенок.
Долгое время считалось, что свободный фтор невозможно получить чисто химическим путём, ведь это самый сильный окислитель. Но теперь учёным известно несколько реакций, в результате которых выделяется свободный фтор. Речь идёт о разложении некоторых сложных фторидов. Примером может служить опубликованное в 1987 г. сообщение о получении фтора по реакции 4SbF5+2K2MnF6=4KSbF6+2MnF3+F2, которая фактически сводится к термическому разложению фторида марганца(IV) на фторид марганца(III) и свободный фтор. Правда, исходное вещество K2MnF6 можно получить, лишь... используя свободный фтор. Данное соединение служит как бы твёрдым аккумулятором газообразного фтора, который, в отличие от самого фтора, значительно безопаснее в обращении.