Хотя прочная оксидная плёнка надёжно защищает титан от окисления, он довольно легко растворяется в плавиковой и концентрированной соляной кислотах: Ti+6HF=H2TiF6+2Н2; 2Ti+6НСl=2TiCl3+3H2.
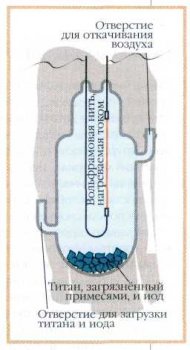
Схема установки для очистки титана методом иодидного рафинирования.

При восстановлении цинком соединений титана (IV) образуется фиолетовый раствор соли титана (III): 2TiOSO4+Zn+2H2SO4= Ti2(SO4)3+ZnSO4+2H2O, из которого добавлением щёлочи может быть осаждён гидроксид Ti(OH)3 (справа).
Свойства титана удивительным образом изменяются при высоких температурах. Нагретый до 800 — 1000 °С, он реагирует не только с галогенами и кислородом, но и с бором, серой, углеродом и даже азотом, образуя твёрдые и хрупкие соединения, примеси которых сильно ухудшают механические свойства металла.
В соединениях титан проявляет, как правило, две степени окисления: +3 и +4. Белый тугоплавкий (tпл=1870 °С) порошок оксида титана (IV) TiO2, получается при сгорании титана в атмосфере кислорода. Прокалённый при высокой температуре ТiO2 химически инертен и используется для приготовления титановых белил. Свежеосаждённый TiO2 проявляет свойства амфотерного оксида — растворяется в концентрированных щелочах и сильных кислотах с образованием бесцветных растворов титанатов и солей титанила ТiO2+:
ТiO2•nH2O+2NaOH=Na2TiO3 •nH2О+Н2О
TiO2•nH2О+H2SO4=TiOSO4+(n+1)Н2О.
При спекании TiO2 с оксидом, пероксидом или карбонатом щелочного или щёлочноземельного металла образуются безводные титанаты:
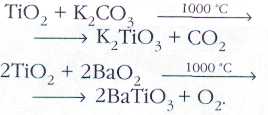
Титанат бария BaTiO3 (tпл=1705°С) проявляет свойства пьезоэлектрика и используется в технике.
При производстве титана рутил ТiO2, переводят в хлорид TiCl4 нагреванием с углём в токе хлора:
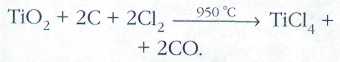
Тетрахлорид титана TiO4 — летучая бесцветная жидкость (tпл=-24 °С, tкип=13б°С), легко гидролизующаяся водой. Для получения металла её восстанавливают натрием или магнием в атмосфере аргона. Такой способ производства титана гораздо проще, нежели прямое восстановление рутила. Водные растворы соединений трёхвалентного титана окрашены в фиолетовый цвет. В инертной атмосфере они устойчивы, но кислород воздуха медленно окисляет их до производных Ti (IV). При действии щелочей на соли Ti (III) образуется пурпурный осадок гидроксида Ti(OH)3.
Похожие статьи