После открытия фторидов ксенона были получены и другие соединения этого элемента, в том числе оксиды, кислоты и их соли. Однако фториды оказались наиболее устойчивыми, и их свойства удалось детально изучить.
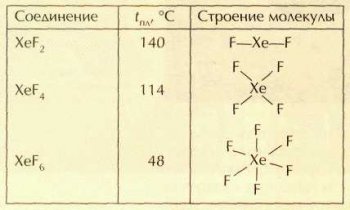
Известно три фторида ксенона: XeF2, XeF4, XeF6. Все они представляют собой легкоплавкие бесцветные кристаллические вещества с характерным запахом, состоящие из молекул.
Фториды ксенона являются энергичными окислителями. Фторид ксенона(П), например, активно окисляет воду: 2XeF2+ 2Н2О = 2Хе0 + О02+4HF, переводит Cl- в Cl2, Мn2+ в MnO-4.
При гидролизе гексафторида ксенона XeF6 может быть получен неустойчивый оксид кceнона (VI) XeO3:XeF6+3Н2О=ХеО3+6HF. Это твёрдое бесцветное взрывоопасное вещество, ангидрид ксеноновой кислоты Н2ХеО4. Исследователи, испытавшие на собственном опыте взрывы соединений благородных газов, сходятся на том, что по чувствительности к детонации ХеО3 сравним с иодистым азотом, а по силе взрыва — с тринитротолуолом. Звук взрыва очень резкий. Взрыв 25 мг ХеО3 вызывает звон в ушах в течение получаса.
Получен также и высший оксид ксенона — ХеО4. В обычных условиях это газ, который разлагается на Хе, О2 и ХеО3 В твёрдом виде ХеО4 взрывается уже при -40 °С.
Кристаллы XeF4.

Похожие статьи