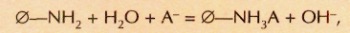Знаменитый немецкий химик Иоганн Рудольф Глаубер рано потерял отца. Денег на обучение в университете Иоганн не имел, пришлось всё постигать самому. Он освоил зеркальное производство и в поисках работы исколесил множество государств и княжеств. Прибыв в 1625 г. в Вену, Глаубер слёг с сильным жаром; его болезнь тогда называли «венгерской лихорадкой» (возможно, это был сыпной тиф). Иоганну удалось поправиться, и он продолжил свои странствия. Однако тяжёлое заболевание не прошло бесследно, но именно благодаря ему Глаубер сделал своё первое значительное открытие. Вот как он сам описывает это:
«Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нейштадта, по-немецки — «нового города», расположенного в 25 км юго-восточнее Бонна. — Прим. ред.). Там у меня снова начались приступы. Болезнь настолько ослабила мой желудок, что он не мог переваривать никакой еды. Местные жители посоветовали мне пойти к источнику, находящемуся в часе ходьбы от города. Они сказали, что вода источника вернёт мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба и отправился в путь, хотя мало верил в целебность воды. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею волы из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и саму корку. Домой я возвратился значительно окрепшим».
За день человек выпивает от силы два литра жидкости. Основная же часть водопроводной воды расходуется на хозяйственные нужды — стирку, умывание и т. д.
При естественной биологической очистке сточные воды выливаются
на поля орошения. Очищенную воду собирают в прудах-накопителях и после отстаивания сбрасывают в водоёмы.
Для искусственной биологической очистки сточные воды поступают в большие ёмкости, через которые продувают воздух. В этих резервуарах вода перемешивается с активным илом, после чего отстаивается. Содержащиеся в иле микроорганизмы перерабатывают большую часть отходов и многие поверхностно-активные вещества. Наконец, воду хлорируют (для обеззараживания) и отстаивают (чтобы удалить хлор и осадить взвешенные частицы), а лишь затем сбрасывают в водоёмы.
Когда вода берётся из открытого источника, чистота которого вызывает сомнения, её нужно обеззаразить. Для этого достаточно воду прокипятить (заодно при кипячении и последующем отстаивании оседают взвешенные частицы). Если такой возможности нет, в воду добавляют перманганат калия KMnO4, обладающий бактерицидным действием. На литр воды достаточно всего нескольких кристалликов этого соединения. Если вода имеет неприятный запах или гнилостный привкус, её можно обработать активированным углём, который сорбирует все растворённые органические соединения, или перманганатом калия, который окисляет их.
Во многих регионах (в первую очередь в степях, полупустынях и пустынях) очень мало пресной воды, зато много солоноватой. Чтобы использовать такую воду для питья и хозяйственных нужд, её приходится опреснять (удалять из неё соли) или умягчать (удалять лишь соли кальция и магния). Для этого применяют ионообменные смолы — органические полимеры, к которым привиты кислотные (как правило, —SO3H) или основные (чаше всего —NH2) группы. Полимеры с кислотными группами, способные обменивать ион Н+на катионы металлов (М+), называются катионитами:
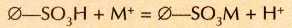
(0 — органическая основа). Полимеры, к которым привиты основные группы, могут связывать анионы (А), обменивая их на ионы ОН-:
и называются анионитами. Если воду пропустить сначала через катионит, а потом через анионит, то катионы и анионы свяжутся ионообменными смолами, а выделяющиеся при этом ионы Н+ и ОН- прореагируют между собой, образовав воду: Н++ОН-=Н2О.
Как правило, пол минеральной водой подразумевают воду, пригодную для питья без дополнительной подготовки и обладающую биологической активностью. Однако по общепринятой международной классификации минеральной считается вода с содержанием солей больше 1 г/л. Если концентрация солей меньше, воду положено называть столовой.
Влияние минеральных вод на организм не всегда можно предугадать. Поэтому их нужно принимать в ограниченном количестве, лучше предварительно проконсультировавшись с врачом. А воды, содержащие свыше 10 г/л солей или специфические биологически активные компоненты, следует пить только по предписанию врача.
Такие воды называют лечебными, в отличие от лечебно-столовых с минерализацией 1—10 г/л.
Прежде чем природная вода станет пригодной для питья, она подвергается осветлению (так называют процесс удаления взвешенных веществ) и обеззараживанию. Иногда воду очищают и от специфических примесей: железа, кальция, магния и др.
Путь воды в наши дома начинается с оголовка — обложенной камнями трубы на дне водоёма. Камни не дают попасть в трубу различным предметам, которые влечёт по дну течение. Далее вода проходит через в колонну с песком, который задерживает крупные частицы, прошедшие оголовок
После фильтрования из воды удаляют все мелкие частицы, часть микроорганизмов, гуминовых кислот и растворённых солей металлов. Для этого в поток воды непрерывно вводят так называемые хлопьеобразователи (флоккулянты) — алюмокалиевые квасцы KAl(SO4)2•12Н2О, сульфат алюминия Al2(SO4), или сульфат железа (III) Fe2(SO4)3. Смешиваясь с природной водой, они реагируют с гидрокарбонат-ионами, образуя очень рыхлые хлопья гидроксидов:
Аl3++3НСО-3= Аl(ОН)3¯+3СО2 Fe3++3НСО-3 = Fe(OH)3¯+3CO2.
После поражения в Первой мировой войне 1914—1918 гг. Германия должна была выплатить странам-победительницам 132 млрд. золотых марок. Если учесть, что одна золотая марка обеспечивалась 0,358423 г чистого золота, немцам предлагалось раскошелиться почти на 50 тыс. тонн золота!
Помочь родному отечеству взялся видный немецкий химик Фриц Габер (подробнее о его судьбе можно узнать из дополнительного очерка «Из истории удобрений»). Он, как, впрочем, и все химики, знал, что реки, особенно протекающие в золотоносных районах, ежегодно выносят в моря и океаны немало золота. Согласно проведённым к тому времени исследованиям, в тонне морской воды содержалось от 2 до 65 мг золота. Вот Габер и решил найти способ извлекать из неё драгоценный металл в промышленных масштабах.
В полной секретности начались подготовительные работы. Два года ушло только на совершенствование методов анализа сверхмалых концентраций золота в воде. Габер использовал способность небольших количеств свинца, осаждаемого из раствора в виде нерастворимого сульфида PbS, увлекать с собой в осадок всё золото, имеющееся в воде. Этот осадок затем восстанавливали до свинца и переплавкой получали маленький шарик (королёк) с примесями золота. Свинец удаляли прокаливанием (он при этом превращался в оксид PbО), а то, что оставалось, сплавляли с бурой. В расплаве и содержалось крохотное зёрнышко золота, которое можно было рассмотреть только под микроскопом. Зная размеры и плотность золотого шарика, легко рассчитать его массу. Этот процесс Габер и решил положить в основу промышленного извлечения золота из морской воды.
Кроме главных ионов, содержание которых в воде достаточно велико, ряд элементов: азот, фосфор, кремний, алюминий, железо, фтор — присутствуют в ней в концентрациях от 0,1 до 10 мг/л. Они называются мезоэлементами (от греч. «мезос» — «средний», «промежуточный»).
Азот в форме нитратов NO-3попадает в водоёмы с дождевой водой, а в форме аминокислот, мочевины (NH2)2CO и солей аммония NH+4— при разложении органических остатков. Фосфор существует в воде в форме гидрофосфатов НРО2-4 и дигидрофосфатов Н2РО-4, образующихся в результате разложения органических остатков.
Кремний попадает в природные воды преимущественно в виде частиц SiO2— продукта разрушения горных пород.
Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Отчасти это связано с тем, что под действием ионов Н+ и ОН- многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение кислотности среды (рН).
Наверняка многие знают, что в болотах вода имеет коричневый цвет. Речные и озёрные воды окрашены гораздо слабее. Окраску природной воде придают гуминовые кислоты — как вымывающиеся из почвы и торфа, так и образующиеся при разложении водных организмов (см. статью «Что под нами»). В холодных климатических зонах (тундре) очень мало органических остатков, и там водоёмы почти не содержат гуминовых кислот. А в зоне лесов, особенно хвойных, где органических остатков образуется много и они не успевают полностью разложиться, содержание гуминовых кислот составляет несколько десятков миллиграммов на литр. Особенно богаты ими болотные воды — 500 мг/л. Гуминовые кислоты не только подкисляют воду в водоёме, но ещё и связывают практически все тяжёлые металлы в прочные комплексные соединения.
Если налить в стакан холодную воду из-под крана и поставить в тёплое место, на стенках появятся пузырьки газа. Газы были растворены в холодной воде и выделились при нагревании (поскольку растворимость газов при нагревании уменьшается). Это кислород, азот и углекислый газ.
Кислород необходим всем организмам для дыхания, а углекислый газ — растениям для фотосинтеза. Кроме того, кислород обеспечивает разложение органических остатков. Когда его в воде мало, органические остатки окисляются не полностью. Образующиеся соединения придают воде специфический запах тины. Что же касается углекислого газа, то он, во-первых, переводит в воду ряд элементов из горных пород, а во-вторых, нейтрализует попадающие в воду основания.
Если для химика слово «соль» означает тысячи самых разных соединений, то для неспециалистов лишь одно — поваренную соль, или хлорид натрия, NaCl. Вкус этой приправы уникален, им не обладает никакое другое вещество! Например, такие соли, как KCl, NaBr, NaI, имеют отчётливый горьковатый привкус.
Без соли поистине нет жизни. У всех народов она символ гостеприимства, радушия. Хлебом-солью встречают самых дорогих гостей. А вот просыпать соль по древним поверьям означало несчастье: на знаменитой фреске Леонардо да Винчи «Тайная вечеря» в трапезной монастыря Санта-Мария делле Грацие в Милане один из апостолов, Иуда Искариот, неловким движением руки опрокидывает солонку.
В теле человека содержится более 200 г NaCl, из которых 45 г растворено в крови. Входящие в соль ионы Na+содержатся в межклеточной жидкости, а ионы Cl-в виде слабого раствора соляной кислоты входят в состав желудочного сока. Взрослому человеку нужно получать в день примерно 10 г NaCl, включая и ту соль,
что находится в употребляемых продуктах. Недостаток её в пище пагубно сказывается на здоровье, а полное отсутствие чревато гибелью.
Природные источники NaCl разнообразны. Соль растворена в морской воде. Минерал галит образует под землёй громадные залежи каменной соли. Только в России её запасы исчисляются десятками миллиардов тонн! Галит содержит до 8 % других солей, в основном магния и кальция. Это придаёт каменной соли особые свойства. Вот почему для засолки грибов или капусты лучше брать менее чистые (и более дешёвые) сорта поваренной соли: благодаря присутствию в них солей магния и кальция продукт приобретает приятный привкус и свойство аппетитно хрустеть.