Кристаллический кремний.
Кварц, горный хрусталь, аметист, халцедон, топаз, оникс... Трудно поверить, но все эти и многие другие «чудеса подземного мира» состоят из одного и того же вещества — кремнезёма, или оксида кремния(IV) SiO2. Предположения о том, что в кремнезёме содержится новый, ещё неизвестный элемент, высказывались учёными уже в XVIII столетии. Однако в виде простого вещества кремний был выделен лишь в XIX в. Й. Я. Берцелиусом. Вначале он нагревал смесь кремнезёма с порошком железа и углём до 1500 °С, но чистый кремний получить не удавалось: в присутствии железа образуется ферросилиций — сплав, содержащий оба эти элемента. Поняв, в чём ошибка, Берцелиус изменил способ синтеза. В 1823 г., когда он пропустил над калием пары фторида кремния(IV), удача наконец улыбнулась ему. По реакции SiF4+4К=Si+4KF был получен порошок аморфного кремния. Берцелиус доказал таже, что, сгорая на воздухе, кремний переходит в кремнезём.
На основе графита в наши дни производится множество различных материалов. Наиболее известен графлекс (от англ. flexible graphite — «гибкий графит»), или пенографит. Для его получения порошок графита пропитывают азотной кислотой, а затем быстро нагревают в восстановительной среде. При этом происходит разложение азотной кислоты, и под давлением образующихся газов слои графита расщепляются и разрываются на хлопья. Получившийся высокопористый материал проходит прокатку и штамповку. Графлекс не подвержен коррозии и применяется в качестве уплотнителя там, где из-за действия высокой температуры нельзя использовать резину или металлы.
Стеклоуглерод — продукт пиролиза (нагревания без доступа воздуха до температуры 800 °С) феноло-формальдегидных смол. Этот материал химически стоек к действию кислот и щелочей. Выполненная из него посуда по многим свойствам не уступает платиновой.
Усилия многих учёных — физиков, химиков, материаловедов — направлены на развитие нанотехнологии — технологических процессов, осуществляемых на молекулярном уровне. Греческая приставка «нано-» означает одну миллиардную часть, т. е. 10-9 (например, 1 нм = 10-9 м).
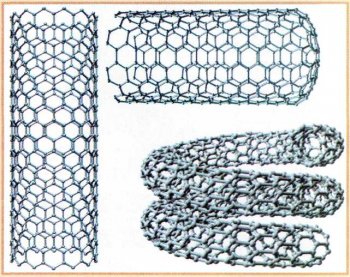
В 1991 г. японские учёные на стенках прибора, в котором проводили синтез фуллеренов, обнаружили наночастицы углерода — полые углеродные трубки диаметром 3—1 0 нм, их стенки состоят всего из нескольких слоёв атомов. С одной стороны каждая такая трубка закрывается «крышкой», которая является не чем иным, как фрагментом структуры фуллерена. Существуют и однослойные нанотрубки — их диаметр всего 0,9 нм. Специалисты предполагают, что нанотрубки, подобно графиту, должны хорошо проводить электрический ток, а возможно, и являться сверхпроводниками. Изучение этих интересных объектов только начинается.
Нанотрубки.
На основе фуллеренов получены полимерные материалы; разрабатываются методы синтеза металлофуллеренов — соединений, содержащих в центре оболочки из атомов углерода атомы металлов (например, лантанидов). Фторированные фуллерены (в частности, C60F48) способны служить катодом в литиевых гальванических элементах, где электрический ток возникает в результате реакции C60F48+xLi=Cb0F48-x+xLiF. Появилась возможность разработки на основе фуллеренов запоминающих устройств со сверхвысокой плотностью информации. Это позволит поместить на один диск огромное количество данных. С использованием фуллеренов предполагается создавать сверхпроводящие материалы, лекарства с противоопухолевой активностью, фотоприёмники, красители.
Графит — наиболее устойчивая при комнатной температуре аллотропная модификация углерода. Теоретически все алмазы должны были уже давно превратиться в графит, но с заметной скоростью такая реакция идёт лишь начиная с температуры около 1000 °С, а при 2000 °С она происходит почти мгновенно. Однако с практической точки зрения гораздо больший интерес представляет обратный процесс — превращение графита в алмаз. Это становится возможным при температуре около 3000 °С и давлении 3•106 атм. К сожалению, алмазы, которые удаётся получить из графита, обычно очень мелкие и невысокого качества. Они могут быть использованы лишь для технических целей.
В XVII—XVIII вв., в период расцвета теории флогистона, считали, что уголь полностью состоит из этого таинственного вещества: ведь при горении угля почти не образуется твёрдого остатка. И только A. JI. Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь — всего лишь простое вещество. Лавуазье назвал новый элемент Carboneum вместо старого латинского названия car-bone pur — «чистый уголь», которым долгое время пользовались химики.
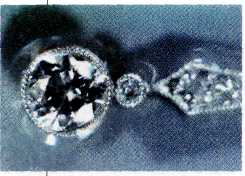
Алмаз является одним из самых твёрдых и тугоплавких (tпл>4000 °С) веществ. В то же время алмаз хрупок: его довольно легко расколоть на части. Аля этого ювелиры пользуются ножом, по которому ударяют молотком. Немногие знают, что алмаз обладает очень высокой теплопроводностью — проводит тепло лучше, чем многие металлы (в 4 раза лучше Cu). В то же время он не проводит электрический ток.
Подобно своим предшественникам по подгруппе, таллий тоже был обнаружен с помощью спектроскопа. Английский химик Уильям Крукс (1832— 1919) занимался извлечением селена из отходов сернокислотного производства. В 1861 г. учёный решил проанализировать собранную им пыль, содержащую селен, — он задался вопросом, нет ли в ней примеси теллура. Каково же было изумление Крукса, когда в спектроскопе он увидел незнакомую ему линию ярко-зелёного цвета, которая принадлежала новому химическому элементу. Его название происходит от греч. «таллос» — «зелёная ветка».
Таллий — это серебристо-белый металл с голубоватым оттенком (tпл=303 °С). В отличие от алюминия,
индия и галлия, оксидная плёнка не спасает его от окисления: на воздухе он быстро темнеет, покрываясь тонким слоем оксида Тl2О. Хранят таллий, как и щелочные металлы, в керосине.
В 1863 г., исследуя с помощью спектроскопа цинковую обманку, директор Фрайбергской горной академии (Германия) Фердинанд Райх (1799—1882) и его ассистент Теодор Иероним Рихтер (1824—1875) обнаружили две линии интенсивного синего цвета, сходного с цветом красителя индиго. Эти линии принадлежали новому элементу, получившему наименование «индий» (от названия «индиго», которое в свою очередь происходит от лат. indikus — «индийский»).
Соединения индия встречаются в незначительном количестве в свинцово-цинковых и медных сульфидных рудах.
Чистый индий — пластичный серебристо-белый металл (tпл=157 °С), устойчивый на воздухе и настолько мягкий, что легко режется ножом.
Индий, как и галлий, используется для получения полупроводниковых материалов: InAs, InSb и др. Введение индия в кремний и германий улучшает их полупроводниковые свойства. Плёнки из оксида индия применяют в электронике в качестве прозрачных электропроводящих покрытий для экранов дисплеев, фотоэлементов.
Галлий принадлежит к числу элементов, открытие которых было предсказано Д. И. Менделеевым. В 1871 г. учёный определил его место в периодической системе, описал основные свойства и даже предположил, что элемент откроют методом спектрального анализа. Слова великого химика оказались пророческими.

Прокаливая на воздухе смесь глины, угля и сульфата натрия, можно получить синюю краску — ультрамарин. Раньше его использовали и для отбеливания белья, льна, крахмала. Примерный состав ультрамарина соответствует формуле Na8Al6Si6О24S. Окраска этого вещества обусловлена наличием в нём атомов серы (точнее, групп S-2, S-3), расположенных а полостях алюмосиликатного каркаса. Под действием соляной кислоты ультрамарин обесцвечивается с выделением сероводорода. В щелочной среде ультрамарин устойчив.
В лабораторной практике в качестве восстановителя обычно используют не чистый алюминий, а сплав Деварда, содержащий 50% меди, 45% алюминия и 5% цинка. Этот сплав, легко растирающийся в порошок, вытесняет водород не только из разбавленных кислот, но и из воды. Активным веществом, входящим в его состав, является всё тот же алюминий, однако в контакте с медью его восстановительные свойства возрастают (образуется медно-алюминиевый гальванический элемент). Сплав Деварда восстанавливает в щелочном растворе нитрат- и нитрит-ионы до аммиака, что используется в химическом анализе.
«Если металлический алюминий облить (или даже просто смочить) раствором сулемы (дихлорида ртути HgCl2. — Прим. ред.), ртуть восстановляется и даёт амальгаму, в виде которой алюминий окисляется очень легко и разлагает воду при обыкновенной температуре...
При обыкновенной температуре металлический алюминий воды не разлагает, но если к ней прибавить немного иода, или йодистого водорода и иода, или йодистого алюминия и иода, водород в обилии выделяется», — читаем в «Основах химии» Д. И. Менделеева.
Лишённый оксидной плёнки, алюминий активно взаимодействует с водой: 2Al + ЗН2О=2АКОН)3¯+3Н2, а на воздухе быстро окисляется, при этом металл нагревается и обрастает белой «бородой» оксида: 4Al + 3О2=2Al2О3. Оксид и гидроксид алюминия амфотерны, т. е. вступают в реакцию как с кислотами (с образованием солей алюминия, например AlCl3), так и с щелочами (образуя алюминаты: Na[Al(OH)4] — в растворе или NaAlO2 — при сплавлении с твёрдой щёлочью). Интересно, что выдержанный при высоких температурах Al2О3 становится инертным — утрачивает способность к взаимодействию даже с концентрированными кислотами.
Алюмотермией называют метод восстановления металлов из оксидов порошком металлического алюминия. Так можно получить корольки (маленькие слитки) многих переходных металлов, например хрома, марганца, ванадия, железа:
2Al+Fe2O3=Al2O3+Fe. Если поджечь с помощью магниевой ленты смесь, состоящую из алюминия и оксида железа, а после этого остывший тигель разбить молотком, из образовавшейся массы (пека) нетрудно извлечь королёк металла.