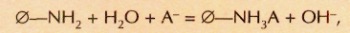Благородный берилл 3ВеО•Аl2О3•6SiO2 принадлежит к числу популярных драгоценных камней. Чистый, не содержащий примесей берилл бесцветный, однако такие камни встречаются в природе крайне редко и не используются в ювелирном деле. Наиболее распространены окрашенные бериллы. Их окраска обусловлена тем, что часть атомов бериллия и алюминия в кристаллической решётке минерала замешена ионами переходных металлов. В зависимости от цвета различают несколько типов бериллов, имеющих особые тривиальные названия.
Изумруд (смарагд) — это ярко-зелёный берилл. Эту окраску ему придают ионы хрома (Сr3+), которые частично замешают ионы алюминия (Аl3+) в кристаллической решётке минерала. Чем больше в изумруде ионов хрома, тем глубже, интенсивнее становится окраска. Обычно изумруды ювелирного качества представляют собой мелкие кристаллы. Однако бывают и исключения. Самый крупный в мире изумруд, найденный в ЮАР на руднике Сомерсет, имел размер 14х35 см и массу 24 000 карат (4,8 кг). Увы, люди не пощадили это чудо, созданное природой: торговцы распилили камень на несколько частей.
Аквамарином называют берилл небесно-голубого, зеленовато-голубого или синего цвета (цвета морской воды: aqua marina — «морская вода»). Считается, что окраска этого камня связана с частичным замещением ионов бериллия и алюминия ионами железа (иона Fe2+ вместо Ве2+ и иона Fe3+ вместо Al3+). Гораздо реже в природе находят бериллы розового и даже красного цвета (воробьевиты, их окраска связана с ионами марганца), а также оранжевые, жёлтые и лимонно-жёлтые (гелиодоры, жёлтый цвет им придают ионы железа).
Кристалл кварца SiO2 построен из кремнекислородных тетраэдров [SiO4], которые расположены по спирали вокруг центральной оси (поэтому различают левовращающие и правовращающие кристаллы — т. е. кристаллы, которые вращают плоскость поляризации света на определённый угол влево и вправо). Кварц встречается в природе не только в виде кварцевого песка, но и в виде красивых камней (найдены
кристаллы кварца весом более тонны), многие из которых издревле использовались человеком.
Горный хрусталь — это кристаллы бесцветного прозрачного кварца, похожие на бриллианты. Согласно древнему поверью, горный хрусталь образуется под действием сильного холода. Недаром это слово происходит от греческого «кристаллос» — «лёд».
Иногда в кварцитовой породе удаётся найти камень гораздо более лёгкий, чем его собратья. Если аккурат-
но распилить его на части, внутри обнаружится полость, поверхность которой покрыта сросшимися друг с другом необычайно красивыми фиолетовыми кристаллами — аметистами.
Окраска этих камней связана с частичным замещением ионов Si4+ в кристаллической решётке кварца на ионы Fe3+ (избыточный заряд компенсируется ионами щелочных металлов или водорода). К сожалению, под действием солнечного света окраска аметистов становится более бледной.
Александрит — одна из разновидностей минерала хризоберилла ВеАl2О4. Многие века этому камню приписывали магические свойства: в Изборнике Святослава (1073 г.) его советуют носить на теле, чтобы уберечься от порчи и проказы.
Александрит является настоящим хамелеоном из-за своих необычных оптических свойств: в зависимости от освещения его окраска изменяется от изумрудно-зелёной (при дневном свете) до фиолетово-красной (при свете электрической лампы). Цвет камня обусловлен примесями, в первую очередь ионов хрома Сr3+. Крупные кристаллы александрита редко встречаются в природе: кристалл размером 6х3 см уже считается выдающейся находкой.
Базальт состоит из тугоплавких минералов, которые раньше других кристаллизуются при застывании. Поэтому базальт, как правило, залегает на большой глубине, хотя иногда при разрушении верхних слоёв земной коры оказывается на поверхности.
Обычно базальт чёрного или тёмно-коричневого цвета. Механически он весьма однороден, а химически — очень стоек. Хотя составляющие базальт минералы (силикаты и алюмосиликаты) считаются тугоплавкими по сравнению с другими, температура плавления этой породы около 1250 °С — меньше, чем у железа. Поэтому базальт используют как сырьё для каменного литья. Из литого базальта изготовляют химически стойкие ёмкости. Из него же делают минеральную вату — очень хороший теплоизолятор. Пятисантиметровая панель из такой ваты по тепло- и звукоизолирующим свойствам равноценна кирпичной стене метровой толщины.
Базальт.
Каолинит Al2[Si2O5](OH)4— основной глинистый минерал. Его кристаллическая решётка состоит из отдельных слоёв, связанных между собой водородными связями. Смешанный с водой каолинит становится пластичным-, в пространство между слоями проникает вода, и слои начинают скользить друг по другу.
Белую глину, или каолин (горную породу, образованную каолинитом), используют как сырьё для изготовления фарфора и фаянса. Мощные пласты каолина располагаются в Подмосковье. Село Гжель, где эта глина выходит на поверхность, издавна славилось своими керамическими изделиями (гжельская керамика).
Мел, мрамор и известняк с химической точки зрения одно и то же вещество — карбонат кальция, а точнее, одна из его кристаллических модификаций — кальцит.
Мел — это мягкая горная порода, которую легко истереть в порошок. Мел используется в качестве белого пигмента в лакокрасочной и резиновой промышленности, в производстве портландцемента, как пишущий материал.
Известняк обладает большей твёрдостью: издавна его использовали как материал для каменных сооружений. Большинство храмов великокняжеской Москвы было построено из мячковского известняка, который добывали у села Мячково на Москве-реке и на специальных судах доставляли к месту постройки. Недаром Москву в старину называли белокаменной. В настоящее время известняк служит ценным материалом при производстве цемента, в металлургии в качестве флюса (флюсом в металлургии называют вещества, вводимые в шихту для связывания примесей, например Р2О5, SiO2, в легкоплавкие шлаки,) и в химической промышленности при производстве соды, хлорной извести, карбида кальция.
При гниении растений в почву переходят составные части древесины — целлюлоза и лигнин. Многочисленные бактерии и некоторые грибы разлагают полимерные молекулы целлюлозы до более коротких олигосахаридов, которые усваиваются растениями. Если бы не «старания» растительных и микроорганизмов, все леса были бы завалены отмершими, но не разложившимися стволами деревьев.
Лигнин — это разветвлённый полимер, содержащий ароматические звенья. Частично он усваивается бактериями, частично — превращается в гуминовые кислоты. Гуминовые кислоты возникают в процессе гумификации — неполного разложения органических остатков. Дальнейшее окисление этих веществ до СО2 и Н2О в природе затруднено из-за отсутствия специфических ферментов, поэтому они накапливаются в почве.
Знаменитый немецкий химик Иоганн Рудольф Глаубер рано потерял отца. Денег на обучение в университете Иоганн не имел, пришлось всё постигать самому. Он освоил зеркальное производство и в поисках работы исколесил множество государств и княжеств. Прибыв в 1625 г. в Вену, Глаубер слёг с сильным жаром; его болезнь тогда называли «венгерской лихорадкой» (возможно, это был сыпной тиф). Иоганну удалось поправиться, и он продолжил свои странствия. Однако тяжёлое заболевание не прошло бесследно, но именно благодаря ему Глаубер сделал своё первое значительное открытие. Вот как он сам описывает это:
«Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нейштадта, по-немецки — «нового города», расположенного в 25 км юго-восточнее Бонна. — Прим. ред.). Там у меня снова начались приступы. Болезнь настолько ослабила мой желудок, что он не мог переваривать никакой еды. Местные жители посоветовали мне пойти к источнику, находящемуся в часе ходьбы от города. Они сказали, что вода источника вернёт мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба и отправился в путь, хотя мало верил в целебность воды. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею волы из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и саму корку. Домой я возвратился значительно окрепшим».
За день человек выпивает от силы два литра жидкости. Основная же часть водопроводной воды расходуется на хозяйственные нужды — стирку, умывание и т. д.
При естественной биологической очистке сточные воды выливаются
на поля орошения. Очищенную воду собирают в прудах-накопителях и после отстаивания сбрасывают в водоёмы.
Для искусственной биологической очистки сточные воды поступают в большие ёмкости, через которые продувают воздух. В этих резервуарах вода перемешивается с активным илом, после чего отстаивается. Содержащиеся в иле микроорганизмы перерабатывают большую часть отходов и многие поверхностно-активные вещества. Наконец, воду хлорируют (для обеззараживания) и отстаивают (чтобы удалить хлор и осадить взвешенные частицы), а лишь затем сбрасывают в водоёмы.
Когда вода берётся из открытого источника, чистота которого вызывает сомнения, её нужно обеззаразить. Для этого достаточно воду прокипятить (заодно при кипячении и последующем отстаивании оседают взвешенные частицы). Если такой возможности нет, в воду добавляют перманганат калия KMnO4, обладающий бактерицидным действием. На литр воды достаточно всего нескольких кристалликов этого соединения. Если вода имеет неприятный запах или гнилостный привкус, её можно обработать активированным углём, который сорбирует все растворённые органические соединения, или перманганатом калия, который окисляет их.
Во многих регионах (в первую очередь в степях, полупустынях и пустынях) очень мало пресной воды, зато много солоноватой. Чтобы использовать такую воду для питья и хозяйственных нужд, её приходится опреснять (удалять из неё соли) или умягчать (удалять лишь соли кальция и магния). Для этого применяют ионообменные смолы — органические полимеры, к которым привиты кислотные (как правило, —SO3H) или основные (чаше всего —NH2) группы. Полимеры с кислотными группами, способные обменивать ион Н+на катионы металлов (М+), называются катионитами:
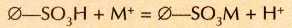
(0 — органическая основа). Полимеры, к которым привиты основные группы, могут связывать анионы (А), обменивая их на ионы ОН-:
и называются анионитами. Если воду пропустить сначала через катионит, а потом через анионит, то катионы и анионы свяжутся ионообменными смолами, а выделяющиеся при этом ионы Н+ и ОН- прореагируют между собой, образовав воду: Н++ОН-=Н2О.
Как правило, пол минеральной водой подразумевают воду, пригодную для питья без дополнительной подготовки и обладающую биологической активностью. Однако по общепринятой международной классификации минеральной считается вода с содержанием солей больше 1 г/л. Если концентрация солей меньше, воду положено называть столовой.
Влияние минеральных вод на организм не всегда можно предугадать. Поэтому их нужно принимать в ограниченном количестве, лучше предварительно проконсультировавшись с врачом. А воды, содержащие свыше 10 г/л солей или специфические биологически активные компоненты, следует пить только по предписанию врача.
Такие воды называют лечебными, в отличие от лечебно-столовых с минерализацией 1—10 г/л.