Товарищи учёные, доценты с кандидатами!
В. С. Высоцкий
В. С. Высоцкий
Когда представляют научного работника, обычно указывают его учёную степень (если, конечно, она есть). Сейчас в Российской Федерации этих степеней две — кандидат и доктор наук. Впервые же учёные степени появились в России в начале XIX в. Они пришли к нам из Германии, где кандидатами называли лиц, сдавших первый государственный экзамен; были, например, кандидаты богословия, медицины, права и т. д.
Исторически это название восходит к Древнему Риму. У римлян соискатель какой-либо должности назывался candidatus, дословно «одетый в белое». Кандидат надевал тогу ослепительно белого цвета (toga Candida) и обходил граждан, которых просил подать за него голос во время выборов. Порой и сейчас кандидаты в кандидаты заранее обходят членов учёного совета, вручают им автореферат диссертации и в явной или неявной форме просят подать за них голос во время тайного голосования на заседании совета. Правда, белых одежд они при этом не надевают.
С 1901 по 1999 г. Нобелевской премии по химии был удостоен 131 учёный из 20 стран мира. Почти треть из них, 47 человек, — профессора из университетов и других научных учреждений США. На втором месте учёные Германии — 27 человек, на третьем химики Великобритании — 23 человека. Далее идут 7 представителей французской науки, 5 швейцарцев, 4 шведа, по 3 исследователя из Голландии и Канады. На долю ещё 12 стран приходится по одному лауреату премии по химии. Среди них и русский учёный Николай Николаевич Семёнов, удостоенный этой награды в 1956 г. «за разработку теории цепных химических реакций».
Трое из перечисленных лауреатов получили Нобелевскую премию дважды. Первой удостоилась столь высокого отличия Мария Склодовская-Кюри. Вместе с мужем, французским физиком Пьером Кюри, в 1903 г. она стала обладательницей Нобелевской премии по физике «за исследования явлений радиации, открытых профессором Анри Беккерелем». Вторая премия, теперь уже по химии, была присуждена Склодовской-Кюри в 1911 г. «за заслуги в исследованиях открытых ею элементов радия и полония, выделении радия и изучении природы и соединений этого удивительного элемента».
Трое из перечисленных лауреатов получили Нобелевскую премию дважды. Первой удостоилась столь высокого отличия Мария Склодовская-Кюри. Вместе с мужем, французским физиком Пьером Кюри, в 1903 г. она стала обладательницей Нобелевской премии по физике «за исследования явлений радиации, открытых профессором Анри Беккерелем». Вторая премия, теперь уже по химии, была присуждена Склодовской-Кюри в 1911 г. «за заслуги в исследованиях открытых ею элементов радия и полония, выделении радия и изучении природы и соединений этого удивительного элемента».

В 1893 г. швейцарский химик Альфред Вернер сформулировал основы теории строения комплексных соединений — координационной теории.
Итак, к середине 90-х гг. здание классической химии в целом было возведено. Успехи химии в XIX в. связаны с тем, что она опиралась на атомно-молекулярное учение. Однако к исходу столетия оно утратило возможности дальнейшего развития. Ведь ничего не было известно о том, как устроен атом. Полагали, что все атомы любого химического элемента одинаковы. Разновидностей атомов столько же, сколько существует химических элементов. Атом — материальное тело, имеющее определённый вес. Вот, собственно, и весь «банк данных» классической атомистики. Как справедливо заметил в 1892 г. Менделеев, «атомы химических элементов остаются неизвестными в своей сущности и представляют только гипотезу».
Конечно, подобное обстоятельство не могло приостановить дальнейшего развития химических исследований. Однако всё чаще и чаще новые открытия, наблюдения, результаты экспериментов не получали необходимых теоретических объяснений.
ПЬЕР ЭЖЕН МАРСЕЛЕН БЕРТЛО
(1827—1907)
(1827—1907)
Он дважды занимал высокие государственные посты: возглавлял Министерство народного образования и изящных искусств, был министром иностранных дел Французской республики.
В Париже его именем названы улица и площадь. Не за заслуги на государственном поприще: Пьер Эжен Марселен Бертло снискал славу величайшего учёного XIX в. И не только как химик: ему принадлежат исследования по физике и биологии. Сотни его статей посвящены гуманитарным наукам: философии, археологии, истории, педагогике... Всего и не перечислишь.
ЙЁНС ЯКОБ БЕРЦЕЛИУС
(1779—1848)
(1779—1848)
Йёнсу Якобу Берцелиусу не исполнилось и тридцати, когда его избрали президентом Шведской академии наук. В одной из своих работ он назвал кислород центром, «вокруг которого вращается вся химия». Можно сказать, что химия первой половины XIX в. «вращалась» вокруг Берцелиуса, и это не преувеличение.
Вот как характеризовал его деятельность видный химик и историк науки Пауль Вальден: «Берцелиус включил в свой строительный план неорганическую и органическую химию, аналитическую и минералогическую, физиологическую и электрохимию. Он дал строительный материал, исследуя химические элементы, число которых увеличил новыми открытиями. Он положил фундамент, расположив атомы по размеру, числу и весу, и связал их электрическими силами. Он больше, чем кто-либо до него, способствовал основанию века количественной химии. Он оставил этому веку новый язык символов, ценные новые понятия и новых мастеров химии».
В физике XIX век ознаменовался разработкой молекулярно-кинетической теории. Закономерности преобразования энергии из одного вида в другой объяснялись с использованием понятия молекулы. Химии для описания состава соединений и химических реакций также был необходим конкретный материальный объект. Таким объектом стал атом. В первые годы XIX столетия английский учёный Джон Дальтон (1766—1844) сформулировал основные принципы химической атомистики. Как заметил немецкий философ Фридрих Энгельс, «новая эпоха в химии начинается с атомистики (следовательно, не Лавуазье, а Дальтон — отец современной химии), а в физике, соответственно этому, — с молекулярной теории».
В чём состояли принципы Дальтона? Во-первых, он принял, что атомы одного и того же вещества тождественны; во-вторых, показал, что разные атомы способны соединяться между собой в различных соотношениях; в-третьих, подчеркнул абсолютную неделимость «простых» атомов (молекулы Дальтон называл «сложными атомами»). Наконец, в 1803—1804 гг. Дальтон ввёл фундаментальное понятие атомного веса — фактически первый количественный параметр, характеризующий атом. Зная атомные веса элементов, можно устанавливать меру химических превращений и химических соотношений веществ, составлять количественные уравнения реакций.
В чём состояли принципы Дальтона? Во-первых, он принял, что атомы одного и того же вещества тождественны; во-вторых, показал, что разные атомы способны соединяться между собой в различных соотношениях; в-третьих, подчеркнул абсолютную неделимость «простых» атомов (молекулы Дальтон называл «сложными атомами»). Наконец, в 1803—1804 гг. Дальтон ввёл фундаментальное понятие атомного веса — фактически первый количественный параметр, характеризующий атом. Зная атомные веса элементов, можно устанавливать меру химических превращений и химических соотношений веществ, составлять количественные уравнения реакций.
АНТУАН ЛОРАН ЛАВУАЗЬЕ
(1743—1794)
(1743—1794)
8 мая 1794 г. нож гильотины оборвал жизнь величайшего учёного XVIII в. «Понадобилось лишь одно мгновение, чтобы отрубить эту голову, но, быть может, и столетия будет мало, чтобы создать подобную ей», — сказал его современник. Общественно-политический деятель и предприниматель Антуан Лоран Лавуазье оказался одной из жертв разгула якобинского террора. Научные заслуги не были приняты во внимание.
До Михаила Васильевича Ломоносова (1711—1765) каких-либо целенаправленных исследований по химии в России не проводилось. Ломоносов создал первую в стране химическую лабораторию. Выстроенная в Петербурге по его плану, она открылась 12 октября 1748 г. По оборудованию не уступала лучшим европейским, а в одном отношении ей, пожалуй, не сыскалось бы равных: лаборатория была физико-химической.
Испытать всё, что только можно измерять, взвешивать и определять вычислением, — вот девиз Ломоносова. Он гораздо раньше других понял: «Химик без знания физики подобен человеку, который всё должен искать щупом. И сии науки так соединены между собой, что одна без другой в совершенстве быть не могут». И потому, утверждал Ломоносов, «вся моя химия физическая». А данное им определение гласило: «...физическая химия — наука, объясняющая на основании положений и опыта физики то, что происходит в смешанных телах при химических операциях». Историк науки Пауль (Павел Иванович) Вальден (1863— 1957) был совершенно прав, считая, что Ломоносов, «предвосхитив своими планами относительно физической химии действительное её возникновение (около 1887 г.) на целое столетие, опередил также основателя количественного периода химии А. Лавуазье на десятилетие...».
Испытать всё, что только можно измерять, взвешивать и определять вычислением, — вот девиз Ломоносова. Он гораздо раньше других понял: «Химик без знания физики подобен человеку, который всё должен искать щупом. И сии науки так соединены между собой, что одна без другой в совершенстве быть не могут». И потому, утверждал Ломоносов, «вся моя химия физическая». А данное им определение гласило: «...физическая химия — наука, объясняющая на основании положений и опыта физики то, что происходит в смешанных телах при химических операциях». Историк науки Пауль (Павел Иванович) Вальден (1863— 1957) был совершенно прав, считая, что Ломоносов, «предвосхитив своими планами относительно физической химии действительное её возникновение (около 1887 г.) на целое столетие, опередил также основателя количественного периода химии А. Лавуазье на десятилетие...».
ГЕНРИ КАВЕНДИШ
(1731—1810)
(1731—1810)
«...Он был крайне застенчив и сдержан. У него не было друзей и было мало знакомых. Вместо того, чтобы охватить своей мыслью всю совокупность природы, он ограничивался исследованием немногих проблем первоклассного значения. Его работы отличались величайшей точностью и изяществом; в сообщении своих выводов он соблюдал величайшую осторожность» — так характеризовал английского учёного Генри Кавендиша один из многочисленных биографов.
Выходец из знатной аристократической семьи, Кавендиш никогда не испытывал недостатка в средствах. (Французский физик Жан Батист Био в некрологе назвал его «самым богатым из учёных и, вероятно, самым учёным из богачей».) Так и не окончив Кембриджский университет, он в 1753 г. поселился в лондонском доме отца. Здесь устроил лабораторию и до конца жизни проводил в ней исследования.
Если бы идеи Джона Мэйоу и его коллег в своё время получили соответствующее теоретическое обоснование, то совершенствование химических знаний могло бы пойти в ином направлении. История распорядилась иначе. Теория, первая химическая теория появилась только на рубеже XVII— XVIII столетий. Почти на протяжении всего XVIII в. она владела умами подавляющего большинства исследователей. Парадокс заключался в том, что в конечном счёте эта теория оказалась ошибочной.
Она вошла в историю под названием теории флогистона. Её создал немецкий химик и врач Георг Эрнст Шталь (1659—1734). В соответствии с этой теорией, все вещества, способные гореть или изменяться при прокаливании (как металлы, которые превращаются в оксиды), содержат невесомый флюид — флогистон (от греч. «флогистос» — «воспламеняющийся»). Таким образом, в процессе горения или обжига вещества теряют, отдают флогистон. Ценность теории состояла в том, что она давала возможность с единой точки зрения объяснять механизмы протекания химических процессов.
Она вошла в историю под названием теории флогистона. Её создал немецкий химик и врач Георг Эрнст Шталь (1659—1734). В соответствии с этой теорией, все вещества, способные гореть или изменяться при прокаливании (как металлы, которые превращаются в оксиды), содержат невесомый флюид — флогистон (от греч. «флогистос» — «воспламеняющийся»). Таким образом, в процессе горения или обжига вещества теряют, отдают флогистон. Ценность теории состояла в том, что она давала возможность с единой точки зрения объяснять механизмы протекания химических процессов.
РОБЕРТ БОЙЛЬ
(1627—1691)
(1627—1691)
Хрестоматийной стала фраза немецкого философа Фридриха Энгельса: «Бойль делает из химии науку».
Он родился в то время, когда эпоха Возрождения заканчивала своё триумфальное шествие по Европе. Физика, математика, науки о земле постоянно обогащались фундаментальными открытиями. Химия оставалась бедной Золушкой. Её ещё слишком опутывали алхимические и схоластические представления.
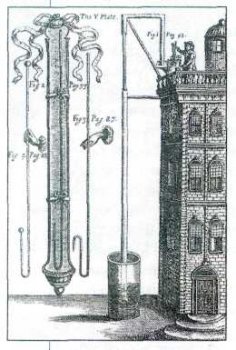
Рисунок из книги Р. Бойля «Химик-скептик». Издание 1661 г.
В XVII столетии механика, физика и астрономия достигают впечатляющих успехов. На их фоне химические исследования и открытия остаются мало кому известными. Однако в фундамент будущего здания химии уже начинают закладываться первые «опорные блоки».
История химии этого периода связана с именами лишь немногих естествоиспытателей. Среди них назовём французского учёного Пьера Гассенди. Он развивал оригинальные атомистические представления. По его мнению, «существует определённое число неделимых и непроницаемых атомов, из которых составлены все тела». Форма атомов может быть различной, и они могут отличаться по размерам и весу. Образование и разрушение тел объясняется соединением атомов и распадом соединений на исходные атомы. Теплота и свет — эти «невесомые флюиды» — также образованы атомами. Гассенди полагал: тела состоят не из первичных атомов, а из их соединений — молекул (от лат. moles — «масса», с уменьшительным суффиксом -cula). Так в 1624 г. в химию вошло одно из важнейших её понятий. Но для того чтобы чётко «расшифровать» его содержание, потребовалось почти три столетия.