Вместе с титаном в состав побочной подгруппы IV группы входят цирконий и гафний. Цирконий был открыт М. Клапротом за несколько лет до титана — в 1789 г. Название ему дали по минералу циркону. Цирконий — не редкий, но рассеянный элемент. В земной коре его больше, чем меди, олова или цинка, однако распылённость циркония настолько велика, что его применение долгое время оставалось ограниченным из-за очень высокой стоимости производства.
Цирконий, очищенный методом иодидного рафинирования.
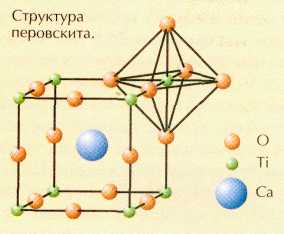
Титанат кальция СаTiO3 встречается в природе в виде довольно редкого минерала, который назван перовскитом в честь русского геолога и политического деятеля XIX в. графа Л. А. Перовского. Впоследствии огромный класс соединений, обладающих схожей структурой, стали именовать перовскитами или перовскитоподобными веществами.
Наиболее изученное перовскитоподобное вещество — титанат бария ВаTiO3. В его кристаллической решётке атомы титана под действием электрического поля способны смещаться со своих позиций. Это приводит к сильной поляризации всего кристалла. На таком эффекте основано использование титаната бария и родственных соединений для преобразования механической энергии сжатия в электрическую. Такие вещества называются пьезоэлектриками (от греч. «пьезо» — «давлю»). Пьезоэлектрики применяются в преобразователях и стабилизаторах частот, эхолокаторах и генераторах ультразвуковых колебаний. Однако их применение часто ограничивается комнатной темпера-
турой. Лишь немногие из них, например цирконат свинца PbZrO3, способны сохранять пьезоэлектрические свойства при нагревании до 300 °С.
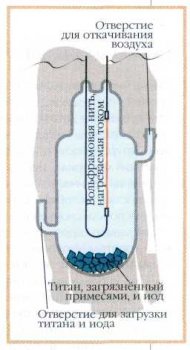
Очень чистый цирконий обладает замечательными свойствами — он жаропрочен, тугоплавок, устойчив к кислотам. Из него изготовляют многие ответственные детали: от кислотостойких клапанов в аппаратах для химической промышленности до скобок и пластин, которыми скрепляют кости при хирургических операциях. Но прежде всего это важнейший конструкционный материал, необходимый при строительстве ядерных реакторов. Цирконий отличается низкой теплопроводностью, большой механической прочностью и стойкостью к коррозии, а главное — не задерживает нейтроны, высвобождающиеся в реакции деления атомных ядер и, следовательно, не мешает протеканию реакции расщепления ядерного топлива на АЭС. Конкурентом циркония в этом отношении мог бы стать магний, но он легкоплавок и к тому же быстро окисляется кислородом воздуха.
При использовании циркония возникли совершенно другие проблемы. В природе цирконий неразлучен со своим верным спутником гафнием: в любой циркониевой руде содержание гафния колеблется от 0,5 до 3 %. Но уже 0,5-процентная примесь гафния делает цирконий непригодным для применения в ядерной технике, поскольку гафний захватывает нейтроны в 500 раз интенсивнее циркония. Из гафния делают стержни, замедляющие и даже полностью прекращающие ядерную реакцию деления. Проблему отделения циркония от гафния учёным удалось решить, но при этом цена циркония (чистотой 99,7 %) возросла в десятки раз. Тем не менее замены цирконию нет, и сейчас ежегодно до 10 тыс. тонн этого металла идёт на нужды ядерной техники.
Поразительна химическая стойкость чистого титана, нередко она более высокая, чем у благородных металлов. На титан, например, не действуют хлорная вода, смесь концентрированных азотной и серной кислот и даже царская водка (золото во всех этих жидкостях растворяется). Объясняется это тем, что уже при обычных условиях на поверхности титана образуется прочная защитная плёнка оксида; под действием же окислителей она становится ещё толще и прочнее.
Исключительно стоек титан и к коррозии. Если в морскую воду погрузить пластинки из алюминия, монеля (медно-никелевого сплава, который используется для чеканки монет), нержавеющей стали и титана толщиной 1 мм, их судьбы окажутся разными. Алюминиевая пластинка уже через несколько дней покроется серыми пятнами (точечная коррозия), а через пять месяцев разрушится. Монелевая — станет тёмно-зелёной из-за взаимодействия меди и никеля с агрессивной морской водой, а примерно год спустя её постигнет судьба алюминиевой. Стальная пластинка продержится года четыре, постепенно покрываясь ржавыми пятнами. Кстати, ракушки и водоросли заметно ускоряют разрушение стали. Титановая же пластинка даже через тысячу лет (!) останется почти невредимой: коррозия проникнет в неё всего на 0,02 мм. В этом отношении титан по стойкости не уступает платине.
Но и у титана есть своя «ахиллесова пята» — он очень «боится» соединений фтора. Во фтороводородной (плавиковой) кислоте обычно стойкий металл растворяется чуть ли не так же быстро, как магниевая стружка в соляной кислоте.
Современные наука и техника нередко нуждаются в сверхвысоком вакууме, который не могут создать обычные ртутные насосы. И тут выручает титан, обладающий способностью прочно связываться с основными компонентами воздуха. В камере титан реагирует с содержащимся в воздухе кислородом и азотом, связывая их в оксид TiO2 и нитрид TiNx (где 0,58<х<1,00), что и создаёт сверхвысокий вакуум,
Это же свойство титана используют для удаления кислорода и азота из стали с целью повышения её качества. Но особенно перспективным оказалось применение тонких покрытий из нитрила титана — одного из самых прочных химических соединений. Используя современные технологии (в том числе лазерные), вещество наносят слоем толщиной всего 2— 3 мкм на поверхность, которую надо сделать твёрдой и износоустойчивой. Покрытые нитридом титана инструменты из быстрорежущей стали (резцы, свёрла, фрезы) и служат дольше, и повышают производительность труда. А выглядят они точь-в-точь как позолоченные — ведь цвет нитрида титана почти такой же, как и у золота.
Нитридные покрытия используются всё шире, например для зубных коронок, «золочения» куполов. Так, купола храма Христа Спасителя в Москве почти полностью покрыты нитридом титана, который отличается чуть более красноватым цветом в сравнении с находящимися неподалёку позолоченными куполами кремлёвских соборов.
Храм Христа Спасителя. Москва.
Титан входит в десятку самых распространённых элементов земной коры, в почвах и горных породах его обычно от 0,5 до 1,5%. Однако некоторые местности особенно богаты титаном. Так, на острове Святой Елены, «где угасал Наполеон», содержание этого элемента достигает 2,5%. Самые же богатые титаном почвы — краснозёмы двух островов Западного Самоа в Тихом океане: в них титана до 12%! Будь этот регион поближе к промышленно развитым странам, вероятно, открытие столь распространённого элемента состоялось бы намного раньше.
По сравнению с другими часто встречающимися металлами титан дороже, поскольку его очень сложно извлекать из руд: он исключительно прочно связан с кислородом.
Как и все наиболее распространённые элементы, титан неизбежно присутствует в живых организмах. У взрослого человека в селезёнке, надпочечниках и щитовидной железе содержится примерно 20 мг Ti. Однако его роль в точности пока не выяснена. Твёрдо установлено, что этот элемент совершенно неядовит. В медицинской литературе описан случай, когда человек съел почти полкилограмма TiO2 — и никаких последствий. Из этого количества диоксида титана можно было бы приготовить целую банку первоклассных белил.
Ещё в начале XX в. никто не предполагал, что через каких-нибудь 30—50 лег малоизвестный металл титан войдёт в число самых важных конструкционных материалов и сплавов, используемых в современной технике. Однако всё по порядку. Хотя минералы титана — рутил TiO2 и ильменит FeTiO3 широко распространены в природе, этот элемент долгие годы оказывался «в тени», его соединения не являлись предметом специальных
исследований. Лишь в 1795 г. известный немецкий химик Мартин Клапрот выделил титан из рутила. Новооткрытый элемент был назван в честь титанов — сыновей Урана (Неба) и Геи (Земли), низверженных Зевсом в царство тьмы. В 1910 г. металлический титан чистотой 99 % удалось получить американскому исследователю Майклу Хантеру при восстановлении тетрахлорида титана металлическим натрием:
TiCl4+4Na®850 °С Ti+4NaCl.
Все элементы VIIIA группы представляют собой одноатомные газы, которые только при очень низких температурах могут быть переведены в жидкое и твёрдое состояние.
Интересно, что температуры кипения и плавления каждого газа различаются всего лишь на несколько градусов. Это объясняется слабым межмолекулярным взаимодействием как в жидкой, так и в твёрдой фазе.
Гелий обладает самой низкой температурой кипения и плавления. Перевести его в твёрдое состояние удаётся только при давлении порядка 25•105Па.
Жидкий гелий впервые получил в 1908 г. нидерландский физик Хейке Камерлинг-Оннес, удостоенный за это Нобелевской премии (1913 г.).
В 1938 г. выдающийся советский физик Пётр Леонидович Капица (1894—1984) установил, что при температурах ниже 2,17 К (-271 °С) жидкий гелий не обладает вязкостью, т. е. становится сверхтекучим. В таком состоянии теплопроводность гелия в миллион раз больше, чем при 4 К (-269 °С). За открытие и исследование этого явления учёному в 1978 г. была присуждена Нобелевская премия, а в 1962 г. Нобелевскую премию получил Лев Давидович Ландау, давший теоретическое обоснование явления сверхтекучести. Сверхтекучесть жидкого гелия позволит использовать его в будущем для создания сверхпроводящих электромагнитов.
Долгое время считалось, что инертные газы не вступают в химические реакции. Однако в 1962 г. канадский химик Нил Бартлетт при нагревании смеси ксенона с сильным окислителем — гексафторидом платины PtF6 получил жёлтое кристаллическое вещество состава XePtF6.
После публикации результатов Бартлетта за один год удалось синтезировать фториды ксенона — XeF2,
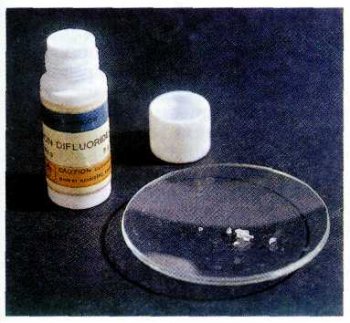
Кристаллы XeF2. Это вещество получают нагреванием смеси ксенона с фтором при 400 °C. Хранят дифторид ксенона в тефлоновых контейнерах.
XeF4, XeF6 — и исследовать их строение и свойства.
К концу XX столетия число полученных соединений ксенона превысило сотню, соединений криптона — уже более двух десятков, среди них KrF2, KrF4, соли криптоновой кислоты Н2KClO4. Самым химически активным должен быть радон, но он слишком нестабилен, и синтезировано всего несколько сто соединений. Теперь очередь за аргоном. Для него пока известны только соединения включения, например клатрат Ar•6Н2О (гидрат аргона), где аргон не образует химической связи, а включён в кристаллическую решётку льда.
Что же касается гелия и неона, то они, надо полагать, навсегда останутся непоколебимыми в своём «благородстве».
После открытия инертных газов и создания «нулевой группы» периодическая система элементов приобрела более законченный вид.
С развитием представлений об электронном строении атомов стало ясно, что инертные газы имеют целиком заполненные s- и р-подуровни. На единственном электронном уровне атома гелия располагаются два электрона (1s2), а остальные представители группы являются p-элементами, и у них на внешнем электронном уровне находятся по восемь электронов (ns2np6 где n — номер периода). Поэтому с точки зрения электронного строения неон и более тяжёлые газы следует поместить в главную подгруппу VIII группы. Гелий можно было бы отнести к s-элементам и формально поставить в группу IIА Однако он настолько непохож по свойствам на элементы II группы: бериллий, магний и другие, что его оставили в VIII группе вместе с подобными ему газами.
Все электроны в атомах гелия, неона и аргона очень прочно связаны с ядром, поэтому эти элементы не вступают в химические реакции. Энергия же р-орбиталей криптона, ксенона и радона позволяет им быть донорами р-электронов при образовании химических связей с наиболее электроотрицательными элементами — фтором, кислородом. Недаром учёные отказались от прежнего названия «инертные» и сейчас именуют эту подгруппу благородными газами.
После открытия фторидов ксенона были получены и другие соединения этого элемента, в том числе оксиды, кислоты и их соли. Однако фториды оказались наиболее устойчивыми, и их свойства удалось детально изучить.
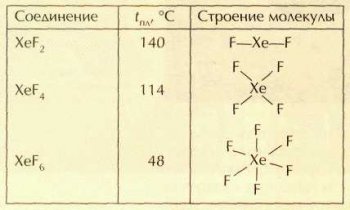
Известно три фторида ксенона: XeF2, XeF4, XeF6. Все они представляют собой легкоплавкие бесцветные кристаллические вещества с характерным запахом, состоящие из молекул.
Фториды ксенона являются энергичными окислителями. Фторид ксенона(П), например, активно окисляет воду: 2XeF2+ 2Н2О = 2Хе0 + О02+4HF, переводит Cl- в Cl2, Мn2+ в MnO-4.