Свинцовые самородки крайне редко встречается в природе. Однако в виде соединения с серой — свинцового блеска, или галенита, PbS — свинец был известен уже древним мастерам. Красивые, блестящие кристаллы этого вещества, по-видимому, привлекли внимание людей. Если положить их в костёр, разведённый в неглубокой яме, на дно её вскоре стечёт расплавленный металл, ведь температура плавления свинца невысока — 327 °С. Так его получали уже в III тысячелетии до н. э. Интересно, что и в наши дни в основе промышленного производства свинца лежат те же химические реакции — прокаливание свинцового блеска на воздухе: 2PbS+3О2=2PbО+2SO2 и восстановление оксида свинца углеродом: PbО+С=Pb+СО. Только древесный уголь заменён гораздо более дешёвым коксом.
В Средние века считали, что свинец, символом которого была планета Сатурн, может превратиться в золото: ведь свинец очень тяжёлый металл. Происхождение латинского названия элемента Plumbum до сих пор вызывает споры среди исследователей.
2Pb+4СН3СООН+О2=2Pb(СН3СОО)2+2Н2О. Образующийся в результате этой реакции ацетат свинца называют свинцовым сахаром за его сладкий вкус. Однако убеждаться в этом самому не следует: все соединения свинца, в особенности растворимые в воде, крайне ядовиты. Cuльное отравление наступает уже при попадании в организм 0,3 г соединений свинца. Тем не менее раствор свинцового сахара до сих пор применяют в медицине как наружное средство: свинцовые примочки накладывают на место ушиба. О способности свинца реагировать с уксусом знали уже в древности: из ацетата свинца в Древнем Риме делали свинцовые белила — смесь основных карбонатов свинца. Эту краску можно также получить взаимодействием свинцового сахара с углекислым газом. Сегодня около половины всего выплавляемого свинца используют в производстве аккумуляторов. Из свинца изготовляют оболочки кабелей, аппаратуру для химической промышленности, пули. Свинцовые экраны хорошо поглощают радиоактивное и рентгеновское излучения.
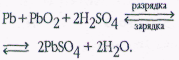
Свинцовый сурик Pb3О4 необходим в производстве красок и эмалей. Оксид свинца(IV) PbO2, являющийся сильным окислителем, входит в состав
спичек. В качестве инициирующего взрывчатого вещества используют азид свинца Pb(N3)2 — соль азидоводородной кислоты HN3.
Свинец образует несколько оксидов.
Низший оксид PbOсуществует в виде двух модификаций: жёлтой —свинцового глёта (слева) и оранжевой —массикота (справа). Оксид свинца(П, IV) Pb3O4 — свинцовый сурик (в центре, вверху) используется в качестве красного пигмента. Высший оксид свинца PbO, (в центре, внизу) является сильным окислителем. Так, он вытесняет хлор из соляной кислоты: PbO2+4HCl = PbCl2+Cl2+2Н2О и воспламеняет сероводород: PbО2+H2S+О2=PbО+SO2+Н2О.
Свинцовый блеск (галенит) PbS внешне похож на графит, только гораздо тяжелее.


Похожие статьи