Разбитый градусник — довольно частая ситуация. Ртуть разбегается в виде мельчайших блестящих шариков, забивается в щели и медленно испаряется, отравляя воздух в помещении. Поэтому разлитую ртуть нужно полностью собрать. В крупных городах удалением ртути из помещений занимаются специальные службы. Если же по какой-то причине связаться с ними не удаётся, нужно поступать следующим образом. В первую очередь откройте окно, чтобы комната хорошо проветривалась. Затем соберите видимые глазом капли ртути, пользуясь зачищенной медной проволокой (а лучше медным проводом, сплетённым из множества тонких проводков) или, в крайнем случае, бронзовой монетой. Ртуть легко прилипает к меди и перестаёт растекаться. Все использованные вами предметы вместе с собранной ртутью сложите в баночку и вынесите на улицу.
Далее надо ликвидировать мелкие капли ртути, которые не удалось собрать, и те, что затекли в щели. Самый надёжный способ — засыпать все места, куда могла попасть ртуть, хлоркой, хлорамином или любым дезинфицирующим средством, содержащим хлор. Подойдут даже хлорсодержащие отбеливатели. Рассыпанный порошок следует смочить (именно смочить, а не залить) водой, и оставить на несколько часов. За это время ртуть превратится в хлорид ртути (II) или оксид ртути (II) (в зависимости от того, что вы использовали). Теперь аккуратно соберите кашицу и сложите её в полиэтиленовый пакет. Остатки хлорки уберите влажной тряпкой, положите её в тот же пакет и отнесите на помойку.
Вместо хлорки ртуть можно обработать насыщенным раствором хлорного железа, которое окисляет металл:
2FeCl3+2Hg=2FeCl2+Hg2CI2,
а через сутки собрать раствор сухой тряпкой (разумеется, в резиновых перчатках). Применяют также настойку иода:
Hg+I2+2KI=K2[HgI4]
или раствор марганцовки. К сожалению, ни хлорное железо, ни иодную настойку нельзя использовать на паркетном полу, а иод ещё и на линолеуме. Ртуть можно также засыпать серой, однако реакция Hg+S=HgS протекает лишь на поверхности ртутных шариков. А из глубины ртуть продолжает спокойно испаряться.
Отравления делятся на острые (если в организм сразу попадает большая доза яда) и хронические (когда человек получает яд понемногу, но постоянно).
История знает немало случаев массового отравления ртутью при золочении различных крупных предметов амальгамой золота. Множество рабочих отравились, когда золотили купола Исаакиевского собора в Санкт-Петербурге. Ртуть или её соли часто оказывались «последним средством» в дворцовых интригах. Ими были отравлены Елена Глинская — мать Ивана Грозного и царица Анастасия — его первая жена. Хроническое ртутное отравление — профессиональная болезнь средневековых шляпников, использовавших соединения ртути для выделки фетра. Безумный Шляпник из кэрролловской «Алисы в Стране Чудес» —типичный пример такого больного. Из-за хронического отравления ртутью потеряли работоспособность Исаак Ньютон, Майкл Фарадей и Блез Паскаль.
Если парами ртути заполнить стеклянную трубку и приложить к её концам напряжение, то в ней возникают заряженные частицы: Hg=Hg++e. При этом ионы ртути устремляются к отрицательно заряженному электроду, а электроны — к положительному. При обратном процессе Hg++е-=Hg* образуются возбуждённые атомы, которые теряют энергию, испуская квант света. Большая часть излучения приходится на ультрафиолетовую часть спектра.
Ртутную лампу называют ещё кварцевой, поскольку трубку делают из кварца, прозрачного для ультрафиолета. Такие лампы используют в лабораториях для проведения фотохимических реакций, в банковском деле для распознания подлинности банкнот, а также в аппаратах искусственного загара. Ультрафиолетовые лучи вредны для глаз, так что ртутная лампа не годится для освещения. Однако стекло лампы можно покрыть изнутри люминофором — веществом, которое поглощает ультрафиолет и при этом излучает видимый свет. Получится так называемая люминесцентная лампа, свет от которой по параметрам соответствует дневному (лампа дневного света).
Ртуть была известна людям уже во II тысячелетии до н. э. Алхимики считали её женским началом веществ, матерью металлов, основой философского камня. Они называли её argentum vivum («живое серебро»), hydrargirum («жидкое серебро») или Mercurius, подчёркивая тем самым её близость к царю металлов — золоту (планета Меркурий расположена ближе всех к Солнцу, символом которого является золото).
Алхимический символ ртути совпадает с обозначением планеты
Меркурий у астрономов:

Кадмий практически не образует собственных минералов и встречается только в виде примесей к цинксодержащим рудам.
В 1817 г. окружной врач Магдебурга Иоганн Ролов заподозрил, что в оксиде цинка, который производили на шёнебекской фабрике Германа, содержится ядовитая примесь — мышьяк.
Соединения кадмия.
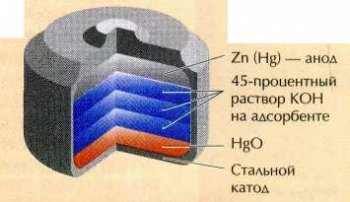
На способности цинка вытеснять ртуть из её соединений основано действие ртутно-цинкового гальванического элемента. В нём протекает следующий процесс: Zn+HgO=Hg+ZnO.
Ртутно-цинковые элементы не имеют равных по надёжности, стабильности напряжения и количеству «запасённого» электричества в единице массы. Они идеальны для использования в полевых условиях.
Однако ртуть составляет больше половины их массы. После того как батарейки выработают свой ресурс, возникает проблема их утилизации. Если просто выбрасывать такие элементы на свалку, воздух в её окрестностях будет отравлен. Поэтому в мире ширится кампания против использования ртутно-цинковых элементов. В частности, в открытую продажу они уже давно не поступают. А на батарейках, которые продаются в магазинах, можно прочесть: «Mercury 0%» или «Mercury free», что означает «ртути нет».
Схема ртутно-цинкового элемента.
Древние металлурги знали, что если минерал галмей (смитсонит ZnCO3) нагреть с углём в присутствии меди, то образуется слиток, по цвету напоминающий золото (впоследствии этот медно-цинковый сплав стали называть латунью). Однако в семёрку известных с древности металлов (железо, медь, золото, серебро, олово, ртуть, свинец), цинк не вошёл, так как его не удавалось выделить в чистом виде. При прокаливании галмея с углём без меди получался странный белый порошок — оксид ZnO, образующийся при взаимодействии паров цинка с кислородом воздуха. Металлический цинк люди научились выплавлять только к началу новой эры. Для этого галмей нагревали с углём в закрытых сосудах, а выделяющиеся пары конденсировали в охлаждаемых глиняных ретортах. Технология по тем временам была достаточно сложной, а химической сути процесса тогда не понимали, поэтому к X в. секрет изготовления цинка оказался утрачен. Вновь о цинке вспомнили спустя несколько столетий. Алхимик Андреас Либавий назвал его восьмым металлом, присоединив к семи металлам древности. А название «цинк» впервые встречается у Парацельса. Выплавку цинка описал Георг Агрикола в своём труде «О горном деле и металлургии». Однако промышленное производство этого металла наладили только в 1743 г. в Бристоле (Англия).