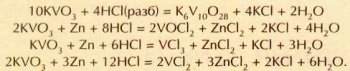Ниобий и тантал отличаются редкостной химической инертностью: для растворения этих металлов требуется смесь плавиковой и концентрированной азотной кислот. Любопытно, что подобный процесс аналогичен растворению циркония или гафния: азотная кислота окисляет металл, а плавиковая способствует образованию устойчивых фторидных комплексов:
Та+5HNO3+8HF=H3TaF8+5NO2+5Н2О.
Устойчивость ниобия и тантала по отношению к щелочным средам не имеет аналогов среди других металлов. Температура плавления тантала около 3000 °С; танталовые тигли легко выдерживают даже металлотермические реакции, в которых выделяется столько теплоты, что плавятся оксиды металлов!
Ванадий — твёрдый и тугоплавкий металл (tпл=1915 °С), химически довольно инертный. Его можно растворить лишь в горячей концентрированной серной или азотной кислоте, царской водке. Именно инертность обеспечила этому металлу широкое применение. Сплав ванадия и никеля, обладающий механическими свойствами стали, многократно превосходит её по химической стойкости. Поэтому его используют для изготовления деталей механизмов, работающих в агрессивных средах.
Ещё большее применение находит феррованадий — сплав ванадия с железом, содержащий до 30 % ванадия. Он сравнительно дёшев и может легко заменять сталь при создании коррозионно-стойких изделий. Даже небольшое (до 1%) содержание ванадия в стали повышает её упругость примерно в два раза!
Химически чистый ванадий получают при восстановлении оксида кальцием: V2O5+5Са=2V+5СаО.
Много ли известно химических элементов, которые были открыты дважды? И уж совсем удивительно, что все три элемента подгруппы — ванадий, ниобий и тантал — носят имена мифологических персонажей.
В 1801 г. мексиканский геолог и минералог Андрес Мануэль дель Рио (1765—1849) нашёл в свинцовой руде примесь неизвестного элемента. Он назвал его эритронием (от греч. «эритрос» — «красный»). Вскоре учёный пришёл к ошибочному выводу, что обнаруженное им вещество не содержит новый элемент, а является смесью железа и хрома, и отказался от своего открытия.
В 1830 г. шведский химик Нильс Габриэль Сефстрём (1787—1845) из отходов производства железа выделил соединения нового элемента, соли которого обладали красивой окраской. В честь древнескандинавской богини красоты Ванадис учёный назвал элемент ванадием. И только в 1869 г. английский химик Генри Энфилд Роско взаимодействием хлорида ванадия(Ш) с водородом получил металл, исследовал его свойства и убедился в том, что ванадий идентичен эритронию дель Рио.
Похожая история произошла с ниобием. В начале XIX в. почти одновременно были открыты и описаны два новых элемента: англичанином Чарлзом Хатчетом (1765—1847) — Колумбий, а шведом Андерсом Экебергом (1767—1813) — тантал. Свойства этих элементов оказались столь схожи, что их приняли за один и стали называть танталом. А в 1844 г. немецкий химик Генрих Розе (1795—1864), исследуя минералы, найденные в Баварии, доказал, что существуют два разных элемента с очень похожими свойствами. Чтобы подчеркнуть их «родство», он назвал второй элемент ниобием в честь Ниобы — дочери героя греческой мифологии Тантала. Интересно, что в США ниобий долгое время продолжали называть колумбием Сb.
Зелёные, густо-красные и золотисто-жёлтые кристаллы силиката циркония ZrSiO4 издавна ценились как красивые драгоценные камни — цирконы, или гиацинты.
Не менее известна кубическая модификация бесцветного диоксида циркония ZrO2 под названием фианит (от аббревиатуры ФИАН — Физический институт Академии наук, где в 1973 г. впервые было получено это соединение). Его кристаллы на первый взгляд трудно отличить от алмазов. Фианиты хорошо полируются, достаточно тверды — по 10-балльной шкале их твёрдость доходит до 8,5, уступая только корунду (9) и алмазу (10).
Вместе с титаном в состав побочной подгруппы IV группы входят цирконий и гафний. Цирконий был открыт М. Клапротом за несколько лет до титана — в 1789 г. Название ему дали по минералу циркону. Цирконий — не редкий, но рассеянный элемент. В земной коре его больше, чем меди, олова или цинка, однако распылённость циркония настолько велика, что его применение долгое время оставалось ограниченным из-за очень высокой стоимости производства.
Цирконий, очищенный методом иодидного рафинирования.
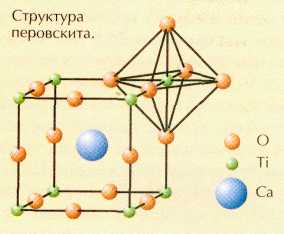
Титанат кальция СаTiO3 встречается в природе в виде довольно редкого минерала, который назван перовскитом в честь русского геолога и политического деятеля XIX в. графа Л. А. Перовского. Впоследствии огромный класс соединений, обладающих схожей структурой, стали именовать перовскитами или перовскитоподобными веществами.
Наиболее изученное перовскитоподобное вещество — титанат бария ВаTiO3. В его кристаллической решётке атомы титана под действием электрического поля способны смещаться со своих позиций. Это приводит к сильной поляризации всего кристалла. На таком эффекте основано использование титаната бария и родственных соединений для преобразования механической энергии сжатия в электрическую. Такие вещества называются пьезоэлектриками (от греч. «пьезо» — «давлю»). Пьезоэлектрики применяются в преобразователях и стабилизаторах частот, эхолокаторах и генераторах ультразвуковых колебаний. Однако их применение часто ограничивается комнатной темпера-
турой. Лишь немногие из них, например цирконат свинца PbZrO3, способны сохранять пьезоэлектрические свойства при нагревании до 300 °С.
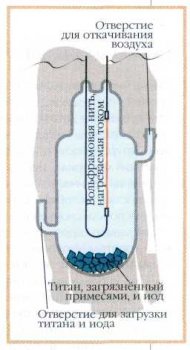
Очень чистый цирконий обладает замечательными свойствами — он жаропрочен, тугоплавок, устойчив к кислотам. Из него изготовляют многие ответственные детали: от кислотостойких клапанов в аппаратах для химической промышленности до скобок и пластин, которыми скрепляют кости при хирургических операциях. Но прежде всего это важнейший конструкционный материал, необходимый при строительстве ядерных реакторов. Цирконий отличается низкой теплопроводностью, большой механической прочностью и стойкостью к коррозии, а главное — не задерживает нейтроны, высвобождающиеся в реакции деления атомных ядер и, следовательно, не мешает протеканию реакции расщепления ядерного топлива на АЭС. Конкурентом циркония в этом отношении мог бы стать магний, но он легкоплавок и к тому же быстро окисляется кислородом воздуха.
При использовании циркония возникли совершенно другие проблемы. В природе цирконий неразлучен со своим верным спутником гафнием: в любой циркониевой руде содержание гафния колеблется от 0,5 до 3 %. Но уже 0,5-процентная примесь гафния делает цирконий непригодным для применения в ядерной технике, поскольку гафний захватывает нейтроны в 500 раз интенсивнее циркония. Из гафния делают стержни, замедляющие и даже полностью прекращающие ядерную реакцию деления. Проблему отделения циркония от гафния учёным удалось решить, но при этом цена циркония (чистотой 99,7 %) возросла в десятки раз. Тем не менее замены цирконию нет, и сейчас ежегодно до 10 тыс. тонн этого металла идёт на нужды ядерной техники.
Поразительна химическая стойкость чистого титана, нередко она более высокая, чем у благородных металлов. На титан, например, не действуют хлорная вода, смесь концентрированных азотной и серной кислот и даже царская водка (золото во всех этих жидкостях растворяется). Объясняется это тем, что уже при обычных условиях на поверхности титана образуется прочная защитная плёнка оксида; под действием же окислителей она становится ещё толще и прочнее.
Исключительно стоек титан и к коррозии. Если в морскую воду погрузить пластинки из алюминия, монеля (медно-никелевого сплава, который используется для чеканки монет), нержавеющей стали и титана толщиной 1 мм, их судьбы окажутся разными. Алюминиевая пластинка уже через несколько дней покроется серыми пятнами (точечная коррозия), а через пять месяцев разрушится. Монелевая — станет тёмно-зелёной из-за взаимодействия меди и никеля с агрессивной морской водой, а примерно год спустя её постигнет судьба алюминиевой. Стальная пластинка продержится года четыре, постепенно покрываясь ржавыми пятнами. Кстати, ракушки и водоросли заметно ускоряют разрушение стали. Титановая же пластинка даже через тысячу лет (!) останется почти невредимой: коррозия проникнет в неё всего на 0,02 мм. В этом отношении титан по стойкости не уступает платине.
Но и у титана есть своя «ахиллесова пята» — он очень «боится» соединений фтора. Во фтороводородной (плавиковой) кислоте обычно стойкий металл растворяется чуть ли не так же быстро, как магниевая стружка в соляной кислоте.
Современные наука и техника нередко нуждаются в сверхвысоком вакууме, который не могут создать обычные ртутные насосы. И тут выручает титан, обладающий способностью прочно связываться с основными компонентами воздуха. В камере титан реагирует с содержащимся в воздухе кислородом и азотом, связывая их в оксид TiO2 и нитрид TiNx (где 0,58<х<1,00), что и создаёт сверхвысокий вакуум,
Это же свойство титана используют для удаления кислорода и азота из стали с целью повышения её качества. Но особенно перспективным оказалось применение тонких покрытий из нитрила титана — одного из самых прочных химических соединений. Используя современные технологии (в том числе лазерные), вещество наносят слоем толщиной всего 2— 3 мкм на поверхность, которую надо сделать твёрдой и износоустойчивой. Покрытые нитридом титана инструменты из быстрорежущей стали (резцы, свёрла, фрезы) и служат дольше, и повышают производительность труда. А выглядят они точь-в-точь как позолоченные — ведь цвет нитрида титана почти такой же, как и у золота.
Нитридные покрытия используются всё шире, например для зубных коронок, «золочения» куполов. Так, купола храма Христа Спасителя в Москве почти полностью покрыты нитридом титана, который отличается чуть более красноватым цветом в сравнении с находящимися неподалёку позолоченными куполами кремлёвских соборов.
Храм Христа Спасителя. Москва.
Титан входит в десятку самых распространённых элементов земной коры, в почвах и горных породах его обычно от 0,5 до 1,5%. Однако некоторые местности особенно богаты титаном. Так, на острове Святой Елены, «где угасал Наполеон», содержание этого элемента достигает 2,5%. Самые же богатые титаном почвы — краснозёмы двух островов Западного Самоа в Тихом океане: в них титана до 12%! Будь этот регион поближе к промышленно развитым странам, вероятно, открытие столь распространённого элемента состоялось бы намного раньше.
По сравнению с другими часто встречающимися металлами титан дороже, поскольку его очень сложно извлекать из руд: он исключительно прочно связан с кислородом.
Как и все наиболее распространённые элементы, титан неизбежно присутствует в живых организмах. У взрослого человека в селезёнке, надпочечниках и щитовидной железе содержится примерно 20 мг Ti. Однако его роль в точности пока не выяснена. Твёрдо установлено, что этот элемент совершенно неядовит. В медицинской литературе описан случай, когда человек съел почти полкилограмма TiO2 — и никаких последствий. Из этого количества диоксида титана можно было бы приготовить целую банку первоклассных белил.