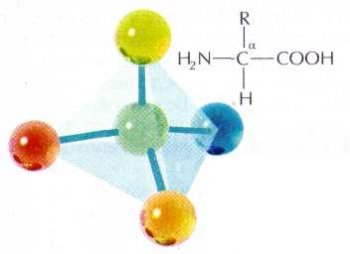
В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа —СООН. Она легко «отпускает на волю» ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа —NH2, и, наконец, четвёртый заместитель — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль.
Свойства «бусинок», отличающие одну аминокислоту от другой, скрыты в R-группах (их ещё называют боковыми цепями). Что же касается группы —СООН, то химики-органики относятся к ней с большим почтением: всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют a-атомом, второй — b-атомом, следующий — g-атомом и т. д. Атом углерода в аминокислотах, который находится ближе всех к карбоксильной группе, т. е. a-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют a-аминокислотами.
В природе встречаются также аминокислоты, в которых NH2-группа связана с более отдалёнными от карбоксильной группы атомами углерода. Однако для построения белков природа выбрала именно a-аминокислоты. Это обусловлено прежде всего тем, что только a-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Число a-аминокислот, различающихся R-группой, велико. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно рассматривать как алфавит «языка» белковой молекулы. Химики называют эти главные аминокислоты стандартными, основными или нормальными. Условно основные аминокислоты делят на четыре класса.
В первый входят аминокислоты с неполярными боковыми цепями. Во второй — аминокислоты, содержащие полярную группу. Следующие два составляют аминокислоты с боковыми цепями, которые могут заряжаться положительно (они объединяются в третий класс) или отрицательно (четвёртый). Например, диссоциация карбоксильной группы даёт анион — СОО-, а протонирование атома азота — катион, например —NH3+. Боковые цепи аспарагиновой и глутаминовой кислот имеют ещё по одной карбоксильной группе —СООН, которая при значениях рН, характерных для живой клетки (рН»7), расстаётся с ионом водорода (Н+) и приобретает отрицательный заряд. Боковые цепи аминокислот лизина, аргинина и гистидина заряжены положительно, поскольку у них есть атомы азота, которые, наоборот, могут ион водорода присоединять.
Каждая a-аминокислота (кроме глицина) в зависимости от взаимного расположения четырёх заместителей может существовать в двух формах. Они отличаются друг от друга, как предмет от своего зеркального отражения или как правая рука от левой. Такие соединения получили название хиральных (от греч. «хир» — «рука»). Хиральные молекулы открыл в 1848 г. великий французский учёный Луи Пастер. Два типа оптических изомеров органических молекул получили названия D-форма (от лат. dexter — «правый») и L-форма (от лат. laevus — «левый»). Кстати, одно из названий других хиральных молекул — глюкозы и фруктозы — декстроза и левулоза. Примечательно, что в состав белков входят только L-аминокислоты, и вся белковая жизнь на Земле — «левая».
Для нормальной жизнедеятельности организм нуждается в полном наборе из 20 основных a-L-аминокислот. Но одни из них могут быть синтезированы в клетках самого организма, а другие — должны поступать в готовом виде из пищевых продуктов. В первом случае аминокислоты называют заменимыми, а во втором — незаменимыми. Набор последних для разных организмов различен. Например, для белой крысы незаменимыми являются 10 аминокислот, а для молочнокислых бакгерий — 16. Растения могут самостоятельно синтезировать самые разнообразные аминокислоты, создавать такие, которые не встречаются в белках.
Для удобства 20 главных аминокислот обозначают символами, используя одну или первые три буквы русского или английского названия аминокислоты, например аланин — Ала или А, глицин — Гли или G.
Структурная формула a-аминокислоты.
Оптические изомеры a-аминокислоты. Подобно предмету и его отражению в зеркале, оптические изомеры не могут быть совмещены в пространстве.
Луи Пастер.
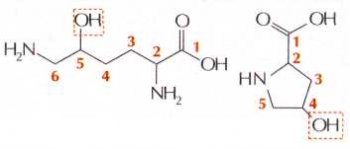
В некоторых белках содержатся особые аминокислоты, не входящие в число двадцати стандартных. Они образуются модификацией нормальных аминокислот. Например, в белке соединительной ткани — коллагене найдены 4-гидроксипролин и 5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной группой. Эта группа необходима для образования прочных волокон коллагена. Недостаток такой модификации пролина и лизина в коллагене приводит к развитию цинги.


Похожие статьи