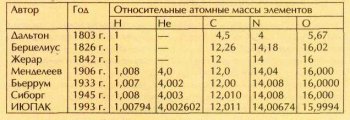
В 1815 г. английский химик и врач Уильям Праут (1785—1850) опубликовал статью «О связи между удельным весом тел в газообразном состоянии и весами их атомов», в которой высказал предположение, что атомные массы всех элементов являются кратными атомной массе водорода. Значит, если за единицу атомной массы взять водород, относительные атомные массы других элементов должны оказаться целыми числами.
Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода.
Это была очень интересная и прогрессивная идея. Из неё следовало, как писал Праут, что водород — это та самая «первоматерия» древнегреческих философов, которая путём «конденсации», «сгущения» даёт все остальные элементы. Тем самым подтверждались единство природы, родство всех химических элементов, возможность «расщепить» их на более простые составные части.
Однако после первого восхищения смелой гипотезой энтузиазм большинства химиков начал быстро угасать. Если атомные массы углерода, азота, кислорода, многих других элементов по водородной шкале действительно оказались очень близки к целым числам, то никакими допущениями о неточности эксперимента невозможно было «сделать целой» атомную массу хлора, равную 35,5. По мере совершенствования методов анализа становилось очевидным, что целочисленные атомные массы — скорее не правило, а исключение.
Поэтому во второй половине XIX в. гипотезу Праута признали неверной. Решающую роль в этом сыграли, пожалуй, исследования бельгийского химика Жана Серве Стаса (1813— 1891); значительный вклад внёс и американский учёный Эдвард Уильям Морли (1838-1923).


Похожие статьи