Внеклеточный матрикс содержит большое число адгезивных неколлагеновых белков, структурной особенностью которых является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот АРГ-ГЛИ-АСП (R-G-D).
Фибронектин — высокомолекулярный гликопротеин. Существуют множественные формы фибронектина. Одна из них — фибронектин плазмы и других биологических жидкостей. Он принимает участие в механизмах свертывания крови и заживления ран. Фибронектины тканей располагаются на поверхности клеток, образуя фибронектиновые филаменты. Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом.
Фибриллин — структурный компонент микрофибрилл, обеспечивающих образование эластиновых волокон. Он найден в хрусталике, периосте, аорте. При мутации гена, кодирующего синтез фибриллина, развивается синдром Марфана: эктопия хрусталика, арахнодактилия («паучьи» пальцы), поражение суставов.
Фибронектин — высокомолекулярный гликопротеин. Существуют множественные формы фибронектина. Одна из них — фибронектин плазмы и других биологических жидкостей. Он принимает участие в механизмах свертывания крови и заживления ран. Фибронектины тканей располагаются на поверхности клеток, образуя фибронектиновые филаменты. Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом.
Фибриллин — структурный компонент микрофибрилл, обеспечивающих образование эластиновых волокон. Он найден в хрусталике, периосте, аорте. При мутации гена, кодирующего синтез фибриллина, развивается синдром Марфана: эктопия хрусталика, арахнодактилия («паучьи» пальцы), поражение суставов.
Главный компонент внеклеточного матрикса — белки. Выделяют 3 группы белков:
▪протеогликаны (ПГ);
▪фибриллярные структурные белки (семейства коллагена и эластина);
▪фибриллярные адгезивные белки (семейства фибронектина и ламинина).
Все эти белки содержат углеводы, поэтому относятся к сложным белкам и называются белково-углеводные комплексы (БУК).
БУК классифицируются по 2 критериям: количеству углеводов в комплексе и качественному углеводному составу:
▪протеогликаны (ПГ);
▪фибриллярные структурные белки (семейства коллагена и эластина);
▪фибриллярные адгезивные белки (семейства фибронектина и ламинина).
Все эти белки содержат углеводы, поэтому относятся к сложным белкам и называются белково-углеводные комплексы (БУК).
БУК классифицируются по 2 критериям: количеству углеводов в комплексе и качественному углеводному составу:
I. Определение N-концевой АК
1. Метод Сэнжера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2. Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3. Взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения.
4. Ферментативный метод (использование аминопептидаз — это ферменты которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
1. Метод Сэнжера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2. Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3. Взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения.
4. Ферментативный метод (использование аминопептидаз — это ферменты которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
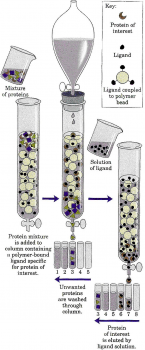
Аффинная хроматография
Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Молекулы веществ (лиманды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Молекулы веществ (лиманды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
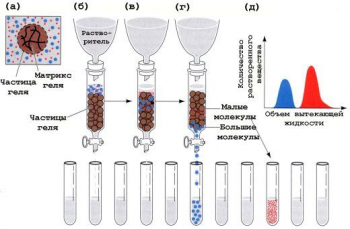
Разделение белков по молекулярной массе
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
Разделение белков по молекулярной массе
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
I. Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение М.
II. Определение N-концевой АК. III. Определение С-концевой АК.
IV. Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЗС); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется
гидратная оболочка.
Устойчивость белка в растворе зависит от:
1)заряда белковой молекуы;
2)наличия гидратной оболочки;
3)молекулярной массы белка.
II. Определение N-концевой АК. III. Определение С-концевой АК.
IV. Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЗС); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется
гидратная оболочка.
Устойчивость белка в растворе зависит от:
1)заряда белковой молекуы;
2)наличия гидратной оболочки;
3)молекулярной массы белка.
Многие белки в своем составе, помимо аминокислот, могут содержать и небелковые компоненты. Эти соединения в составе белков называют простетической группой. Простетические группы с белком соединяются разными типами связей.
В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов.
1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины).
Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями.
2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков — это гликопротеины.
В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов.
1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины).
Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями.
2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков — это гликопротеины.
Кислотно-основные свойства
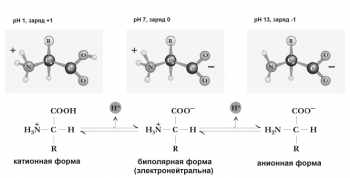
1.Амфотерность
Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, увеличивается диссоциация карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот.
1.Амфотерность
Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+-групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, увеличивается диссоциация карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот.
I. По строению радикала
1.Алифатические (гли, ала, вал, лей, илей).
2.Гидроксиаминокислоты (сер, тре).
3.Дикарбоновые (асп, глу).
4.Амиды дикарбоновых кислот (асн, глн).
5.Серосодержащие (мет, цис).
1.Алифатические (гли, ала, вал, лей, илей).
2.Гидроксиаминокислоты (сер, тре).
3.Дикарбоновые (асп, глу).
4.Амиды дикарбоновых кислот (асн, глн).
5.Серосодержащие (мет, цис).
1.Регуляторная (пептиды ренин-ангиотензивной системы и др.).
2.Гормоны (окситоцин, инсулин, глюкагон).
3.Антибиотики (пенициллин, цефалоспорины).
4.Токсины (аманитотоксин).
5.Антиоксиданты (глутатион).
6.Нейропептиды (энкефалины, эндорфины — обезболивающий эффект). Главные составные части белка — аминокислоты.
2.Гормоны (окситоцин, инсулин, глюкагон).
3.Антибиотики (пенициллин, цефалоспорины).
4.Токсины (аманитотоксин).
5.Антиоксиданты (глутатион).
6.Нейропептиды (энкефалины, эндорфины — обезболивающий эффект). Главные составные части белка — аминокислоты.
I. Функциональная (по функции, выполняемой в организме)
1.Каталитическая (более 3000 белков — ферменты).
2.Сократительная (актин, миозин и т. д.).
3.Структурная (белки плазматических мембран, коллаген, эластин и др.).
4.Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.).
5.Защитная (антитела, иммуноглобулины).
1.Каталитическая (более 3000 белков — ферменты).
2.Сократительная (актин, миозин и т. д.).
3.Структурная (белки плазматических мембран, коллаген, эластин и др.).
4.Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.).
5.Защитная (антитела, иммуноглобулины).
Мембраны – это надмолекулярные структуры, отделяют клетку от окружающей среды и делят ее на компартменты. Различают внешнюю (плазматическую) и внутриклеточные мембраны органелл (ядра, митохондрий, лизосом и т.д.).
Состоят мембраны из белков и липидов. Белков до 60 – 85% от массы, а в миелиновых мембранах (окружают нервы) больше липидов. Основу липидного слоя составляют фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин, холестерин.
Фосфолипиды амфипатические соединения: гидрофильная головка (Рн. + глицерол), гидрофобный хвост – радикалы жирных кислот. В состав фосфолипидов входят ненасыщенные жирные кислоты. Образуется двуслойная мембрана, липидный бислой, в который встроены белки: поверхностные (располагаются на поверхности мембраны) и интегральные (пронизывают мембрану насквозь). Липидный слой находится в текучем состоянии. Молекулы фосфолипидов и белков двигаются вдоль поверхности мембраны. Поэтому говорят о латеральной диффузии компонентов мембран. Холестерин уплотняет липидный бислой мембран, делает его более прочным и уменьшает текучесть мембранных липидов. Ассиметрия мембраны – на внешней поверхности белков больше чем на внутренней.
Состоят мембраны из белков и липидов. Белков до 60 – 85% от массы, а в миелиновых мембранах (окружают нервы) больше липидов. Основу липидного слоя составляют фосфолипиды: фосфатидилхолин, фосфатидилэтаноламин, холестерин.
Фосфолипиды амфипатические соединения: гидрофильная головка (Рн. + глицерол), гидрофобный хвост – радикалы жирных кислот. В состав фосфолипидов входят ненасыщенные жирные кислоты. Образуется двуслойная мембрана, липидный бислой, в который встроены белки: поверхностные (располагаются на поверхности мембраны) и интегральные (пронизывают мембрану насквозь). Липидный слой находится в текучем состоянии. Молекулы фосфолипидов и белков двигаются вдоль поверхности мембраны. Поэтому говорят о латеральной диффузии компонентов мембран. Холестерин уплотняет липидный бислой мембран, делает его более прочным и уменьшает текучесть мембранных липидов. Ассиметрия мембраны – на внешней поверхности белков больше чем на внутренней.