Распад большинства аминокислот начинается с переаминирования. Эти реакции не высвобождают аммиак, а переносят аминогруппу с аминокислоты на кетокислотный акцептор. Трансаминазы используют пиридоксальфосфат в качестве коэнзима. Это главный путь удаления азота у аминокислот. Существуют трансаминазы для большинства аминокислот. После поступления пищевых аминокислот из воротной вены печень трансаминирует значительную часть аминокислот. Исключением являются аминокислоты с разветвленным углеводородным радикалом, для них в печени нет соответствующей трансаминазы. Концентрация таких аминокислот в крови, оттекающей от печени, выше, чем в системе воротной вены.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число -кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует -кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров.
Стратегия реакции переаминирования — перенос аминогруппы от различных групп донорных аминокислот на ограниченное число -кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует -кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы обычно называют по аминокислотам, которые служат донором аминогруппы.
Субстратная специфичность трансаминаз. Каждая трансаминаза специфична для одного или нескольких аминокислотных доноров.
-Глутамильный цикл. Главную роль в этой транспортной системе играет мембраносвязанный фермент -глутамилтрансфераза. Фермент катализирует перенос - глутамильной группы от глутатиона на транспортируемую аминокислоту. Затем комплекс - глутамиламинокислота поступает в клетку. Далее с помощью еще пяти внутриклеточных ферментов происходит освобождение из дипептида свободной аминокислоты и ресинтез затраченной на транспорт молекулы глутатиона.
Компоненты желудочного сока:
1)НCl — секретируется обкладочными клетками вместе с электролитами;
2)гастрин — полипептидный гормон, секретируемый слизистыми клетками желудка;
3)пепсиноген — неактивный предшественник пепсина, секретируется главными клетками желудка.
Функции желудочного сока:
1)Гастрин секретируется в ответ на поступление химуса в желудок; два места приложения действия гастрина:
обкладочные клетки: стимулирует секрецию НСl;
главные клетки: стимулирует секрецию пепсиногена.
2)НСl снижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
1)НCl — секретируется обкладочными клетками вместе с электролитами;
2)гастрин — полипептидный гормон, секретируемый слизистыми клетками желудка;
3)пепсиноген — неактивный предшественник пепсина, секретируется главными клетками желудка.
Функции желудочного сока:
1)Гастрин секретируется в ответ на поступление химуса в желудок; два места приложения действия гастрина:
обкладочные клетки: стимулирует секрецию НСl;
главные клетки: стимулирует секрецию пепсиногена.
2)НСl снижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
Протеолитические ферменты вовлекаются в большое число разнообразных физиологических процессов. Протеолиз может протекать вне клеток и внутриклеточно. Действие протеолитических ферментов может быть разделено на две различные категории:
1)ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
2)неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
Протеазы классифицируются по типу их механизма катализа. Международный союз по биохимии и молекулярной биологии выделяет четыре класса протеаз:
Сериновые протеиназы
Аспарагиновые протеиназы
Цистеиновые протеиназы
Металлопротеиназы
1)ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
2)неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
Протеазы классифицируются по типу их механизма катализа. Международный союз по биохимии и молекулярной биологии выделяет четыре класса протеаз:
Сериновые протеиназы
Аспарагиновые протеиназы
Цистеиновые протеиназы
Металлопротеиназы
Азотистый баланс — общий показатель обмена белка в организме. Азотистый баланс — это разница между поступлением азота (обычно в форме белка) и его выведением (обычно в форме неусвоенного белка из кишечника и мочевины — почками). Положительный азотистый баланс наблюдается при задержке азота в организме, что отмечается при росте, беременности или в послеоперационном периоде. Отрицательный азотистый баланс отражает общую потерю белков, нередко связанную с неполноценным белковым питанием. У здорового взрослого человека отмечается азотистое равновесие, при котором потери азота компенсируются поступлением белков с пищей.
Норма белка в питании — 80–100 г.
Биологическая ценность белков определяется наличием и соотношением незаменимых аминокислот: вал, лей, илей, тре, мет, фен, три, лиз (для детей еще арг и гис).
Норма белка в питании — 80–100 г.
Биологическая ценность белков определяется наличием и соотношением незаменимых аминокислот: вал, лей, илей, тре, мет, фен, три, лиз (для детей еще арг и гис).
Основными инструментами в работе молекулярного биолога с нуклеиновыми кислотами являются ферменты. Используют рестриктазы (эндонуклеазы, которые узнают специфические последовательности в ДНК и разрезают молекулу ДНК в этом месте), ДНК- полимеразы, ДНК-лигазы, экзонуклеазы и др.
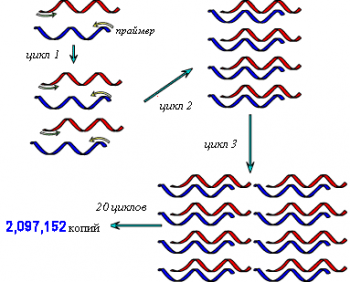
В настоящее время в основе большинства методов ДНК-диагностики лежит
полимеразная цепная реакция (ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК (или их фрагментов), достаточное для их даль- нейшего анализа.
Этапы проведения:
▪нагревание до 90 С (денатурация ДНК);
▪добавление праймера и охлаж- дение до 55 С (присоединение или «от-жиг» праймера);
▪добавление нуклеотидов (суб- стратов для синтеза) и ДНК- полимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
В настоящее время в основе большинства методов ДНК-диагностики лежит
полимеразная цепная реакция (ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК (или их фрагментов), достаточное для их даль- нейшего анализа.
Этапы проведения:
▪нагревание до 90 С (денатурация ДНК);
▪добавление праймера и охлаж- дение до 55 С (присоединение или «от-жиг» праймера);
▪добавление нуклеотидов (суб- стратов для синтеза) и ДНК- полимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
Селен является дефицитным и абсолютно незаменимым микроэлементом. Он является мощным антиоксидантом, защищая ткани от свободнорадикальной деструкции как самостоятельно (например, защищая SH-группы от окисления), так и в составе глутатиопероксидазы (Se входит в состав её активного центра) — важнейшего фермента антиоксидантной системы организма. Селен — составная часть тироксин-5-дейодазы, обеспечивающей синтез гормона щитовидной железы — трийодтиронина. Селен — классический антиканцероген, что объясняется его антиоксидантными свойствами.
Суточная потребность — 100 мкг.
Суточная потребность — 100 мкг.
Всасываясь из слизистой кишечника, медь в портальном кровотоке адсорбируется альбуминами и белком транскупреином и поступает в печень — центральный орган обмена меди. В печени медь либо запасается, либо включается в Cu-содержащие ферменты. В плазме крови Cu связывается с ферментом церулоплазмином (α2-глобулин), имеющим голубую окраску. Церулоплазмин обладает оксидазной активностью (окисляет аскорбиновую кислоту, адреналин, ДОФА и др.). Он играет ведущую роль во взаимосвязи обмена Cu и Fe.
Роль меди в обмене веществ. Медь входит в состав многих ферментов: цитохромоксидазы (фермент дыхательной цепи), моноаминоксидазы (обезвреживание биогенных аминов), церулоплазмина, каталазы (обезвреживание Н2О2), тирозиназы (синтез меланина), супероксиддисмутазы (обезвреживание О2–), лизилоксидазы (синтез коллагена и эластина).
Суточная потребность — 2–3 мг. При недостатке меди в рационе может развиваться железодефицитная анемия, так как медь непосредственно участвует в метаболизме железа.
Роль меди в обмене веществ. Медь входит в состав многих ферментов: цитохромоксидазы (фермент дыхательной цепи), моноаминоксидазы (обезвреживание биогенных аминов), церулоплазмина, каталазы (обезвреживание Н2О2), тирозиназы (синтез меланина), супероксиддисмутазы (обезвреживание О2–), лизилоксидазы (синтез коллагена и эластина).
Суточная потребность — 2–3 мг. При недостатке меди в рационе может развиваться железодефицитная анемия, так как медь непосредственно участвует в метаболизме железа.
Содержание железа в организме — 3–5 г, наибольшее его количество (2/3) приходится на гемоглобин, 4,5 % — на миоглобин, 2 % находится в составе ферментов. Оно может быть геминовым (железо гема и других порфиринов) либо негеминовым (в составе фермента аконитазы и железосерных белков, входящих в комплексы дыхательной цепи). Fe принимает участие в связывании, транспорте и депонировании О2 (гемоглобин и миоглобин), в транспорте электронов в дыхательной цепи (цитохромы), в окислительно-вос- становительных реакциях (некоторые оксидоредуктазы), реакциях гидроксилирования (цитохром Р450) и обезвреживания перекисей (каталаза и пероксидазы).
Железо всасывается в верхней части тонкого кишечника. При возрастании потребности в нём (кровопотери) Fe всасывается эффективнее. Улучшает всасывание железа витамин С. Фосфаты и фитаты зерновых растений затрудняют его всасывание. Из просвета кишечника свободное железо захватывается муцином слизистой. Интегрин на поверхности мембраны щёточной каёмки энтероцита облегчает транспорт Fe внутрь клетки, где железо связывается с белком мобилферрином. Этот белок «собирает» железо изо всех отсеков цитозоля энтероцита и переносит Fe в кровь, где Fe3+ сразу же связывается с белком апотрансферрином — образуется трансферрин (гликопротеин). Трансферрин, помимо транспортной функции, защищает также ткани от токсического действия свободных ионов железа. Затем, связываясь со специфическим мембранным рецептором, трансферрин поступает вместе с ним в клетки кроветворных органов. После освобождения от Fe трансферриновый рецептор возвращается в плазматическую мембрану.
Железо всасывается в верхней части тонкого кишечника. При возрастании потребности в нём (кровопотери) Fe всасывается эффективнее. Улучшает всасывание железа витамин С. Фосфаты и фитаты зерновых растений затрудняют его всасывание. Из просвета кишечника свободное железо захватывается муцином слизистой. Интегрин на поверхности мембраны щёточной каёмки энтероцита облегчает транспорт Fe внутрь клетки, где железо связывается с белком мобилферрином. Этот белок «собирает» железо изо всех отсеков цитозоля энтероцита и переносит Fe в кровь, где Fe3+ сразу же связывается с белком апотрансферрином — образуется трансферрин (гликопротеин). Трансферрин, помимо транспортной функции, защищает также ткани от токсического действия свободных ионов железа. Затем, связываясь со специфическим мембранным рецептором, трансферрин поступает вместе с ним в клетки кроветворных органов. После освобождения от Fe трансферриновый рецептор возвращается в плазматическую мембрану.
Наибольшее его количество (85 %) находится в костной ткани. Фосфор — важнейший вне- и внутриклеточный анион. Внутри клетки он связан с белками и липидами («органический фосфор»). Фосфор внеклеточного пространства находится в виде одно- и двузамещённых фосфатов, образующих в плазме крови буферную систему (поддержка нормы рН). Фосфор является одним из ингредиентов, определяющих буферные свойства мочи.
Участие в метаболизме. Органический фосфор входит в состав нуклеиновых кислот, коферментов, фосфолипидов, он служит энергоносителем, входит в состав вторичных посредников гормонов, участвует в образовании коферментной формы водорастворимых витаминов. В клетках путём фосфорилирования осуществляется регуляция активности регуляторных ферментов.
Обмен фосфора тесно связан с процессами поступления и освобождения из костей кальция: увеличение поступление Са2+ в организм приводит к повышению выведения фосфора с мочой. Контроль внеклеточной концентрации фосфора осуществляется почками:
под влиянием паратирина реабсорбция фосфатов снижается. Основными причинами гипофосфатемии являются гиперпаратиреоидизм, врожденный дефект реабсорбции фосфора в почках, недостаточность питания, онкологические заболевания.
Суточная потребность составляет около 1 г.
Участие в метаболизме. Органический фосфор входит в состав нуклеиновых кислот, коферментов, фосфолипидов, он служит энергоносителем, входит в состав вторичных посредников гормонов, участвует в образовании коферментной формы водорастворимых витаминов. В клетках путём фосфорилирования осуществляется регуляция активности регуляторных ферментов.
Обмен фосфора тесно связан с процессами поступления и освобождения из костей кальция: увеличение поступление Са2+ в организм приводит к повышению выведения фосфора с мочой. Контроль внеклеточной концентрации фосфора осуществляется почками:
под влиянием паратирина реабсорбция фосфатов снижается. Основными причинами гипофосфатемии являются гиперпаратиреоидизм, врожденный дефект реабсорбции фосфора в почках, недостаточность питания, онкологические заболевания.
Суточная потребность составляет около 1 г.
В животных жирах содержится холекальциферол (витамин Д3), в растительных — эргокальциферол Д2 (кальциферол означает несущий кальций). В организме человека витамин Д3 образуется в качестве промежуточного продукта при биосинтезе холестерола (из 7-дегидрохолестерола) в клетках кожи под влиянием УФ-лучей.
Метаболизм. Кальциферолы поступают в печень в составе хиломикронов. В печени образуется 25(ОН)-Д3, т. е. 25 гидроксихолекальциферол, затем 25(ОН)-Д3 попадает в кровь и, связываясь специфическим транспортным белком, переносится в почки. В почках образуется 1,25(ОН)2-Д3 (1,25-дигидроксихолекальциферол, или кальцитриол). Эта реакция активируется паратиреоидным гормоном. В реакциях гидроксилирования принимает участие витамин С. Витамин Д3 накапливается в жировой ткани.
Метаболизм. Кальциферолы поступают в печень в составе хиломикронов. В печени образуется 25(ОН)-Д3, т. е. 25 гидроксихолекальциферол, затем 25(ОН)-Д3 попадает в кровь и, связываясь специфическим транспортным белком, переносится в почки. В почках образуется 1,25(ОН)2-Д3 (1,25-дигидроксихолекальциферол, или кальцитриол). Эта реакция активируется паратиреоидным гормоном. В реакциях гидроксилирования принимает участие витамин С. Витамин Д3 накапливается в жировой ткани.
Гормон синтезируется паращитовидными железами. Он является полипептидом (84 аминокислоты). Краткосрочная регуляция секреции паратгормона осуществляется Са++, а в течение длительного времени — 1,25(ОН)2D3 cовместно с кальцием.
Паратгормон взаимодействует с 7-ТМС-(R), что приводит к активации аденилатциклазы и повышению уровня цАМФ. Помимо этого, в механизм действия паратгормона включаются Са++, а также ИТФ и диацилглицерол (ДАГ). Основная функция паратгомона заключается в поддержании постоянного уровня и Са++. Эту функцию он выполняет, влияя на кости, почки и (посредством витамина D) кишечник. Влияние паратгормона на остеокласты ткани осуществляется в основном через ИТФ и ДАГ, что в конечном итоге стимулирует распад кости. В проксимальных канальцах почек паратгормон угнетает реабсорбцию фосфатов, что ведет к фосфатурии и гипофосфатемии, он увеличивает также реабсорбцию кальция, т. е. уменьшает его экскрецию. Кроме того, в почках паратгормон повышает активность 1-гидроксилазы. Этот фермент участвует в синтезе активных форм витамина D.
Паратгормон взаимодействует с 7-ТМС-(R), что приводит к активации аденилатциклазы и повышению уровня цАМФ. Помимо этого, в механизм действия паратгормона включаются Са++, а также ИТФ и диацилглицерол (ДАГ). Основная функция паратгомона заключается в поддержании постоянного уровня и Са++. Эту функцию он выполняет, влияя на кости, почки и (посредством витамина D) кишечник. Влияние паратгормона на остеокласты ткани осуществляется в основном через ИТФ и ДАГ, что в конечном итоге стимулирует распад кости. В проксимальных канальцах почек паратгормон угнетает реабсорбцию фосфатов, что ведет к фосфатурии и гипофосфатемии, он увеличивает также реабсорбцию кальция, т. е. уменьшает его экскрецию. Кроме того, в почках паратгормон повышает активность 1-гидроксилазы. Этот фермент участвует в синтезе активных форм витамина D.