Атомы углерода могут соединяться в цепочки практически любой длины. В природе существуют органические вещества, молекулы которых содержат длинные углеродные цепи, например основу пчелиного воска составляет сложный эфир мирицилпальмитат C15H31COOC31H63. Синтетические же полимеры — это углеродные цепи состоящие из сотен тысяч атомов.
К тому же углеродный каркас достаточно прочен: энергия связи С—С сопоставима с энергией связи С—О.
По этой причине углеродные соединения часто оказываются устойчивыми как к нагреванию, так и к действию иных разрушающих факторов — освещению, агрессивным химическим средам.
И наконец, углеродный каркас подвижен, нежёсток: цепи углеродных атомов, соединённых простыми одинарными связями, могут изгибаться, сворачиваться и другими способами изменять свою форму.
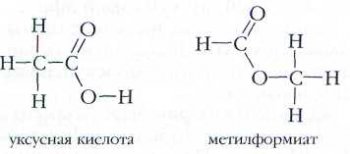
Одна из причин многообразия органических веществ — явление изомерии. Существуют органические соединения, которые имеют одинаковый элементный состав, но отличаются друг от друга по свойствам — как физическим (агрегатное состояние, температура кипения, плавления), так и химическим. Например, формуле С2Н6О соответствуют два разных вещества — жидкий при нормальных условиях этиловый спирт и газообразный диметиловый эфир.
Разные вещества, имеющие одинаковый элементный состав, но различающиеся строением молекул, называют изомерами.
Явление изомерии было открыто в 1824 г. Юстусом Либихом и Фридрихом Вёлером. Проводя независимо друг от друга исследования, они обнаружили, что существуют два вещества одинакового состава, но с разными свойствами — циановая кислота Н—О—CºN и так называемая гремучая (фульминовая) кислота Н—CºN—O. Термин «изомер» (от греч. «изос» — «равный» и «мерос» — «мера», «часть») был предложен Якобом Берцелиусом позднее, в 1830 г.
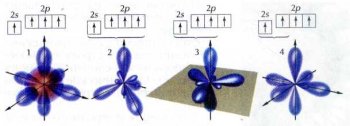
Орбитали возбуждённого атома углерода:
1 — негибридизованные;
2 — sp3-гибридизация;
3 — sр2-гибридизация;
4 — sp-гибридизация.

Углеродная цепь обладает большой гибкостью, оставаясь при этом очень прочной.
Якоб Хендрик Вант-Гофф.
Изомеры делят на два больших класса — структурные и пространственные.
Структурными называются изомеры, отличающиеся строением молекулы (порядком соединения атомов в молекуле). Органические молекулы проявляют три вида структурной изомерии.
1. Изомерия углеродного скелета. Её существование для насыщенных углеводородов — алканов впервые обнаружил в 1866 г. А. М. Бутлеров, получив изобутан (метилпропан):
Число изомеров быстро возрастает с увеличением количества атомов углерода в молекуле.
2. Изомерия, связанная с различным положением заместителя или кратной связи в молекуле:
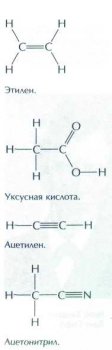
3. Межклассовая изомерия. В этом случае изомерами являются вещества, содержащие разные функциональные группы и не относящиеся к одному классу органических соединений:
Что касается пространственной изомерии, то ещё в первой половине XIX в. было известно о существовании нескольких веществ с одной и той же молекулярной формулой, различающихся лишь по некоторым физическим признакам. В 1832 г. Берцелиус отметил подобный случай изомерии для виноградной и виннокаменной кислот. Однако объяснить это явление различием в строении молекулярного скелета не удалось, поскольку химическое поведение веществ было одинаковым. Проблема значительно усложнилась, когда в 1848 г. французский учёный Луи Пастер открыл левовращающую винную и мезовинную кислоты. После почти десятилетних исследований Пастер пришёл к выводу, что причиной этого явления может быть существование молекулярной асимметрии (его работы по данному вопросу напечатаны под общим заглавием «Молекулярная диссимметрия»). Теория асимметрического атома углерода была детально разработана в 1874 г. Якобом Вант-Гоффом и изложена им в книге «Химия в пространстве». Основу стереохимии Вант-Гоффа составляет учение о тетраэдрическом строении молекулы метана.
Молекулы, которые являются зеркальными изображениями друг друга и поэтому не совместимы при поворотах в пространстве, как правая и левая перчатки, называют оптическими изомерами. Существуют такие элементы структуры, которые могут сделать молекулу асимметричной и неидентичной её зеркальному изображению. Чаще всего встречается наиболее важный из них — асимметрический атом углерода, связанный с четырьмя разными заместителями. Простейшим примером может служить молекула молочной (2-гидроксипропановой) кислоты: СН3СН(ОН)СООН.
Многие соединения не содержат асимметрических атомов углерода, но обнаруживают тем не менее явление оптической изомерии. Условия для изомерии такого типа возникают в случае, когда вращение фрагментов молекулы относительно друг друга затруднено. Например, молекула аллена
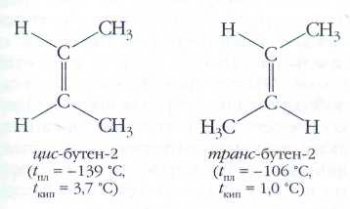
СН2=С=СН2 из-за двойных связей углеродного атома является жёсткой, её концевые группы СН2 лежат в двух взаимно перпендикулярных плоскостях. Поэтому все замещённые аллены типа XYC=C=CXY (где X и Y — различные заместители) асимметричны и могут существовать в виде двух несовместимых оптических изомеров. У алкенов и других соединений с двойными связями существует пространственная изомерия, возникшая из-за отсутствия свободного вращения вокруг двойной связи; её называют геометрической, или цис-транс-изомерией (лат. cis — «с той же стороны» и trans — «с противоположной стороны»). Она появляется тогда, когда каждый из sp2-гибридных углеродных атомов связан с двумя разными заместителями. Простейший пример — бутен-2:
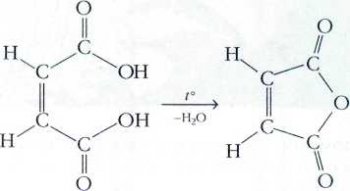
Первые случаи геометрической изомерии были отмечены немецким химиком Йоханнесом Вислиценусом (1835—1902) в 70-х гг. XIX в. на примерах фумаровой и малеиновой кислот. Применив теорию Вант-Гоффа, он приписал этим кислотам правильные пространственные формулы, что помогло объяснить различия в их химических свойствах. Несмотря на то что обе кислоты представляют собой геометрические изомеры одной и той же бутендиовой кислоты, они могут по-разному проявлять себя в химических реакциях. Цис-изомер, или малеиновая кислота tпл=139 °С), при нагревании до 160 °С теряет воду и превращается в циклический ангидрид малеиновой кислоты:
Транс-изомер, или фумаровая кислота (tпл=288 °С), не может непосредственно перейти в малеиновый ангидрид: при нагревании до 300 °С он возгоняется и превращается в смесь малеиновой кислоты и небольшого количества малеинового ангидрида.
Существование явления изомерии делает разнообразие органических молекул прямо-таки устрашающим. Если для простейших молекул, содержащих несколько углеродных атомов, количество изомеров исчисляется десятками, то можно представить, каковы возможности в этом плане у сложных молекул природных соединений. Так, если в молекуле белка имеется 100 различных асимметрических центров (это вполне обычное и даже не слишком большое число), то должно существовать 1043 возможных оптических изомеров.
Оптические изомеры молочной кислоты.
Так называемые затруднённые конформеры могут проявлять оптическую активность.

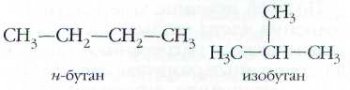
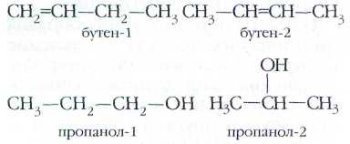

Похожие статьи