Щелочные металлы представляют собой серебристо-белые (литий, натрий, калий, рубидий) или желтоватые (цезий) вещества с металлическим блеском, с низкими температурами плавления и кипения. Цезий, находящийся в запаянной ампуле, легко плавится в руке (tпл=29°С), натрий переходит в жидкое состояние при 98°С. Все щелочные металлы чрезвычайно активны. Литий и натрий на воздухе мгновенно покрываются плотной плёнкой кислородных соединений, но загораются лишь при нагревании, а калий, рубидий и цезий — уже при комнатной температуре. Поэтому хранят щелочные металлы под слоем керосина или в запаянных сосудах. Интересно, что продуктами их горения на воздухе (за исключением лития) являются не оксиды, а пероксиды (в случае натрия) и надпероксиды (в случае калия, рубидия и цезия).
Взаимодействие калия с водой.
Эти элементы являются типичными металлами. В их атомах на внешнем уровне имеется всего один электрон (ns1), который они легко отдают, превращаясь в положительно заряженные ионы с электронной конфигурацией инертного газа. Восстановительная активность металлов закономерно возрастает с увеличением порядкового номера. В этом легко убедиться на примере их взаимодействия с водой. Все щелочные металлы вытесняют из воды водород, образуя щёлочи: 2М+2Н2О=2МОН+Н2. С литием реакция протекает спокойно. Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Вскоре под действием выделяющейся при реакции теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Стоит задержать её на месте, прижав пинцетом к стенке сосуда или положив в воду лист фильтровальной бумаги, как капля воспламеняется и сгорает ярко-жёлтым пламенем. Калий загорается сразу при попадании в воду, а рубидий и цезий вспыхивают на воздухе ещё до того, как их успевают внести в сосуд с водой.
Соединения щелочных металлов окрашивают пламя в характерные цвета. Так, соли лития придают ему карминово-красный цвет, соли натрия — жёлтый, калия — фиолетовый, а рубидия и цезия — тоже фиолетовый, но более светлого оттенка.
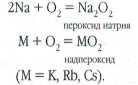
Так же интенсивно протекают реакции со многими неметаллами — галогенами, серой, фосфором. Однако с азотом натрий и калий не взаимодействуют, а с графитом образуют лишь соединения включения, в которых атомы металла находятся между отдельными слоями в структуре графита.
Натрий и другие щелочные металлы довольно сложно получить в лаборатории, хотя это и можно сделать, например, прокаливая соду с углём: Na2CO3+2С=3СО+2Na.
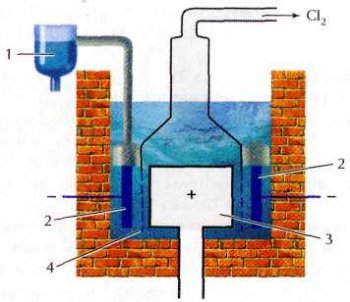
Схема электролизёра для получения натрия:
1 — приёмник натрия;
2 — катод; 3 — анод;
4 — расплав NaCl+CaCl2
В промышленности натрий получают электролизом расплава смеси хлоридов натрия и кальция (она плавится при более низкой температуре, чем чистый хлорид натрия). Интересно, что первым из расплава выделяется не кальций, а более активный натрий, так как ион Na+ в расплаве легче, чем Са2+, принимает электроны. Процесс проводят в стальных электролизёрах при 580 °С. Образующийся жидкий натрий всплывает на поверхность расплава и собирается в специальный приёмник.
Ежегодно в мире производится около 200 тыс. тонн металлического натрия, который применяется на атомных электростанциях и в авиадвигателях в качестве теплоносителя, в металлургии — как восстановитель, в лабораторной практике — для абсолютирования (обезвоживания) растворителей.
Литий, как и натрий, получают электролизом расплавов, а остальные щелочные металлы вытесняют из расплавленных солей металлическим натрием или кальцием. Например, натрий при 850 °С легко вытесняет более активный калий из расплава его хлорида:
КСl+Na ®t°NaCl+К.
Это объясняется тем, что калий (tкип=762 °С), более летучий, чем натрий (tкип=883 °С), испаряется (уходит из сферы реакции), и в соответствии с принципом Ле Шателье равновесие реакции смещается вправо. Аналогично из хлорида цезия удаётся получить цезий: Са+2CsCl=2Cs+CaCl2.
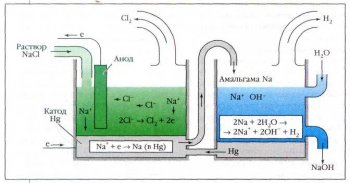
Схема установки для получения гидроксида натрия. В электролизёре (слева) проводится электролиз раствора NaCl с ртутным катодом. Образующаяся амальгама натрия поступает в ванну (справа), где она разлагается водой с образованием NaOH и выделением водорода. Ртуть возвращается назад в электролизёр.


Похожие статьи