Благодаря малому размеру коллоидных частиц общая площадь их поверхности может быть очень велика. Отношение общей поверхности к массе частиц (оно называется удельной поверхностью Sуд ) резко возрастает при уменьшении размера частиц. Так, для капель воды диаметром 1 мкм Sуд = 6000 м2/кг, т. е. общая поверхность литра мелких водяных капель в 10 раз больше участка в шесть соток! Тончайший поверхностный слой всегда имеет более высокую энергию, чем вещество во внутреннем объёме тела. Ведь молекулы, расположенные на поверхности, взаимодействуют только с соседями снизу и сбоку, так что у них остаётся «неистраченная сила». Избыточная энергия, отнесённая к единице площади, характеризует поверхностное натяжение с. Вот почему коллоидные частицы обладают избытком энергии по сравнению с той же массой сплошного вещества. «Лишняя» энергия делает коллоидную систему неустойчивой: в ней могут самопроизвольно протекать процессы, ведущие к «сбросу» этого избытка. Подобное происходит, например, при уменьшении удельной поверхности. Значит, в коллоидной системе термодинамически выгодны процессы укрупнения частиц. Они протекают по-разному для твёрдых частиц, капель и газовых пузырьков.
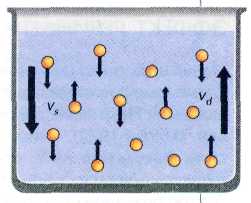
В коллоидной системе со временем устанавливается равновесие между процессами диффузии и седиментации.
Центрифуга — аппарат для механического разделения смесей под действием центробежной силы.
Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую форму.
*Адсорбция (от лат. ad — «на», «при» и sorbeo — «поглощаю») — поглощение какого-либо вещества поверхностным слоем другого вещества.
Капли в аэрозолях и эмульсиях, пузырьки в жидкости, совершая броуновское движение, периодически соприкасаются и сливаются в более крупные. Такой процесс носит название коалесценция {от лат. coalesco — «срастаюсь», «соединяюсь»). Твёрдые частицы, конечно, не могут слиться в одну. Они просто прилипают друг к другу, причём каждая сохраняет исходную форму. Это называется коагуляцией (от лат. coagulatio — «сгущение», «свёртывание»).
Коалесценция и коагуляция ведут к агрегации (от лат. aggrego — «присоединяю»), т. е. укрупнению дисперсных частиц. Постепенно они становятся настолько большими, что особенности, присущие коллоидным системам, исчезают. Крупные капли и агрегаты твёрдых частиц или выпадают в осадок, или всплывают, если образующее их вещество легче дисперсионной среды. Общий итог — «гибель» коллоидной системы.
Для разного рода прикладных задач может оказаться важным как сохранить коллоид (т. е. не позволить ему расслоиться на две фазы), так и разрушить коллоидную систему. Например, один из основных способов добычи нефти — вытеснение её из пласта нагнетаемой водой. При этом в добытой нефти часто содержится много воды в виде мельчайших капель, т. е. она представляет собой водно-нефтяную эмульсию. Воду необходимо отделить, и для этого нужно разрушить эмульсию.
Проблемой устойчивости коллоидных систем занимались многие видные учёные, среди них академики Борис Владимирович Дерягин (1902— 1994), Лев Давыдович Ландау (1908— 1968), Пётр Александрович Ребиндер. Они выявили два решающих физико-химических фактора устойчивости. Первый из них — электрический. Наличие у частиц зарядов одинакового знака, положительного или отрицательного, создаёт электростатическое отталкивание, удерживающее частицы далеко друг от друга. Так, для получения коллоидных частиц AgI необходимо проводить реакцию KI с AgNO3 в разбавленных растворах
при избытке иодида калия. Это обеспечивает накопление ионов I- на поверхности только что образовавшихся маленьких кристалликов AgI, и они приобретают отрицательный заряд. При стехиометрическом соотношении реагентов кристаллики AgI получаются незаряженными. Они слипаются, и коллоидная система быстро разрушается — иодид серебра выпадает в осадок.
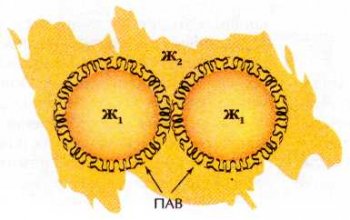
Другой принцип стабилизации коллоидов основан на введении в них особых, так называемых поверхностно-активных веществ (ПАВ). Молекулы ПАВ состоят из двух частей с резко различными химическими свойствами: гидрофильной группы и гидрофобной — достаточно длинного углеводородного радикала. К ПАВ относятся спирты (начиная с пропилового), жирные кислоты и их соли (мыла), другие органические вещества. Одним из концов молекулы ПАВ прилипают к поверхности коллоидных частиц. Плотный слой этих молекул подобен тонкой, но прочной оболочке. Он препятствует контакту частиц, пузырьков или капель друг с другом и защищает их от слипания.
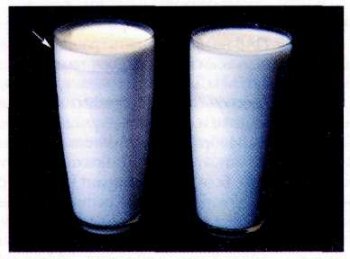
Выделение сливок на поверхности молока — пример нарушения седиментационно-диффузионного равновесия в эмульсии.

Форма поверхности застывшего окрашенного воска. Искривление поверхности — образование мениска — результат действия двух сил: поверхностного натяжения и взаимодействия со стенкой фарфорового стаканчика.
Существуют способы «продления жизни» коллоидных систем. Эмульсии, например, стабилизируют с помощью поверхностно-активных веществ.
П. А. Ребиндер назвал эти защитные слои структурно-механическим барьером. Примером могут служить белки, находящиеся в молоке: молекулы белков адсорбируются на капельках жира и на длительный срок предотвращают их слияние. Чтобы удалить с жировых капель защитный слой белка и получить таким образом сливочное масло, необходимо приложить значительные механические усилия.
Закончим рассказ о коллоидах провидческими словами Д. И. Менделеева, сказанными ещё в 1871 г.: «Вопросы коллоидной химии должно считать передовыми и могущими иметь значение во всей физике и химии».

Похожие статьи