В разбавленных растворах плохо растворимых солей устанавливается равновесие между твёрдым кристаллическим осадком и ионами в растворе: часть ионов из кристаллов непрерывно переходит в раствор, и такое же количество — из раствора в осадок. Если перемножить концентрации ионов в растворе, то получится постоянная (при данной температуре) величина, которая называется произведением растворимости и обозначается ПР; так, для BaSO4 ПР = [Ва2+]•[SO2-4] (квадратные скобки означают, что берётся концентрация иона, выраженная в молях на литр раствора). В том случае, когда вещество образует в растворе несколько катионов и анионов, их концентрации возводятся в соответствующую степень; так, для PbI2 ПР = [Pb2+]•[I-]2.

Осадки хлорида, бромида и иодида серебра.
Если резко уменьшить концентрацию катионов или анионов над осадком, то он начнёт растворяться, посылая в раствор новые и новые порции ионов, чтобы сохранить постоянство ПР. Есть разные способы, позволяющие уменьшить концентрацию ионов. Одни ионы можно превратить в газообразные соединения, которые улетучатся из раствора, например: СО2-3+2Н+=СО2+Н2О (именно поэтому малорастворимые карбонаты, в частности мел, легко растворяются в кислотах). Другие ионы могут быть связаны подходящим реагентом в малодиссоииированное соединение: ОН- + Н+=Н2О (поэтому растворяются в кислотах малорастворимые гидроксиды металлов). Теоретически любая соль будет растворена, если только найти вещество, которое снизит концентрацию в растворе хотя бы одного из её ионов.
Эти рассуждения можно проиллюстрировать эффектной цепочкой превращений, в которых участвуют ионы серебра. Выпишем значения ПР типичных нерастворимых соединений серебра и рассчитаем по ним концентрации ионов серебра в водном растворе над осадком:
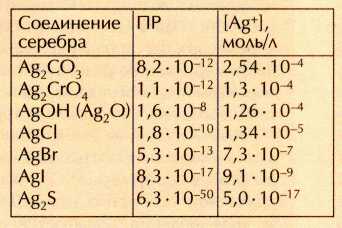
Уже первое вещество — Ag2CO3 в воде практически не растворяется. Но если добавить к бесцветному раствору над желтоватым осадком Ag2CO3 несколько капель раствора хромата калия К2СrО4 и перемешать смесь, осадок Ag2CO3 немедленно исчезнет и появится тёмно-красный осадок Ag2CrO4. Произошло это потому, что ионы Ag+, находящиеся над осадком Ag2CO3, начали быстро связываться хромат-ионами в менее растворимое соединение. На смену им из осадка стали поступать новые ионы серебра, которые тут же «перехватывались» хромат-ионами. В конце концов все ионы серебра, входившие в состав карбоната, вошли в состав нового осадка — хромата серебра.
Аналогично хромат серебра легко превратить в менее растворимый тёмно-коричневый оксид серебра Ag2O, затем — в ещё менее растворимый белый осадок AgCl. Если теперь к AgCl добавить немного раствора аммиака, осадок моментально растворится: ионы Ag+ свяжутся с молекулами аммиака в прочный комплекс состава [Ag(NH3)2]+.
Однако в растворе ещё остаётся небольшое количество свободных ионов серебра, поэтому при добавлении бромида калия аммиачный комплекс начинает распадаться, выделяя новые и новые порции ионов Ag+, которые немедленно переходят в осадок AgBr. Чтобы он растворился, выбирают комплексообразователь посильнее. Им служит, например, тиосульфат натрия Na2S2O3, анионы которого в растворе образуют более прочный, чем аммиак, комплекс состава [Ag(S2O3)2]3-. Именно поэтому тиосульфат натрия используют в фотографии для растворения бромида серебра.
В присутствии тиосульфата в растворе осталось ещё меньше свободных ионов серебра, но их концентрация достаточна, чтобы при добавлении иодида калия достичь величины ПР для AgI; эта соль и выпадет в осадок жёлтого цвета. Настала очередь иодида. Растворить его ещё труднее, чем бромид, — уж очень мала концентрация Ag+ в растворе над осадком. Но если к осадку добавить раствор сульфида натрия, он сразу почернеет: это образовался Ag2S — наименее растворимая соль серебра.
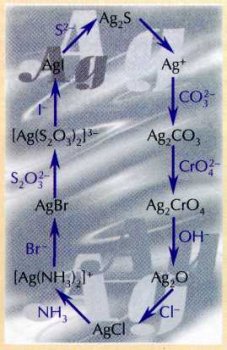
Серебро из сульфида можно перевести в раствор с помощью азотной кислоты: 3Ag2S + 8HNO3=6AgNO3+2NO+3S+4Н2О. Круг замкнулся: серебро снова находится в виде хорошо растворимой соли — нитрата. Итак, путешествие ионов серебра из осадка в раствор и обратно закончилось. Вот карта его маршрута:
Похожие статьи