Роль глии в механизмах памяти рассматривается в контексте её роли в модификации синапсов, актуализации и возникновения новых связей между нейронами. Все этапы формирования, удержания и воспроизведения следа памяти включают биохимические изменения в нейронах и глиальных клетках, в первую очередь – сателлитных. Исключительная роль при этом отводится нейроспецифическим белкам, в частности белку S-100, который мигрирует в нейрон из глии и влияет на синтез РНК и пластические модификации в синаптических мембранах. Как уже указывалось, нейроглиальные клетки принимают активное участие транспорте многих нейромедиаторов в системе глия-нейрон, в частности, глутамата, роль которого в регуляции длительности сохранения следа памяти не подвергается сомнениям. Согласно гипотезе А.И.Ройтбака образование и укрепления временных связей сопровождается усилением миелинизации центральных аксонов и изменениями топографических взаимоотношений нейронов и ближайших нейроглиальных клеток. С продуцированием глионами специфических нейропептидов связано также превращение «потенциальных» синапсов в эффективнные, что многими авторами рассматривается как важнейший этап формирования следов памяти.
Изучение процессов метаболизма мозга на протяжении цикла бодрствование-сон показало активную роль глии в белковом обмене внутри нейроглиального комплекса. В состоянии медленноволнового сна значительно увеличивается (по сравнению с состоянием бодрствования) число рибосом в цитоплазме глиальных клеток в зоне их контакта с нейронами. По времени это совпадает с уменьшением среднего количества рибосом в нейронах. Усиление белкового синтеза глиальными клетками во время медленноволнового сна обеспечивает, как полагают исследователи, последующий (в парадоксальную фазу сна) транспорт синтезированных веществ из сателлитной глии в нейроны, количество рибосом и уровень синтеза белка в которых во время медленноволнового сна снижается. При переходе из стадии медленноволнового к стадии быстрого сна наблюдается возрастание числа рибосом в нейронах и снижение в сателлитных глиоцитах. Таким образом, при медленноволновом сне имеет место перемещение доминирующего источника энергии от нейронов к глии.
Длительные колебания электрических потенциалов в коре мозга (секундного диапазона и выше) многие авторы связывают с активностью апикальных дендритов и нейроглии. По мнению А.И. Ройтбака медленные отрицательные потенциалы, регистрируемые с поверхности коры в состоянии покоя и, особенно, в условиях различных воздействий, обусловлены активацией нейроглии верхних корковых слоёв, накоплением в глио-нейрональном пространстве ионов калия, вызывающих деполяризацию верхушечных дендритов. Обнаружен определённый параллелизм в развитии отрицательной медленной волны, развивающейся при электрическом раздражении поверхности коры мозга и колебаниями мембранного потенциала нейроглильных клеток, регистрируемого микроэлектродом в зоне стимуляции. При этом временное течение процессов изменений поляризации мембраны нейроглиоцита не всегда совпадает с динамикой медленной волны ЭЭГ. В пользу того, что отрицательный сдвиг потенциала на поверхности коры отражает деполяризацию глиальных клеток свидетельствует совпадение порогов раздражения для формирования ответов. При усилении силы раздражения обе реакции параллельно возрастают. Было обнаружено, что во время эпилептического разряда каждому судорожному потенциалу соответствовала медленная деполяризация мембраны глиальных клеток. Подобный феномен наблюдается также при распространяющейся депрессии, вызываемой аппликацией на кору раствора хлористого калия. Предполагается также участие глии в формировании так называемой «волны ожидания», описанной Г.Уолтером. В сетчатке глаза протея обнаружено, что течение медленной положительной волны b электроретинограммы практически совпадает с динамикой деполяризации мюллеровских клеток – глиальной системы сетчатки. Похожие параллели описаны и для других структур центральной нервной системы – зрительных нервов лягушки и протея, гигантского аксона кальмара, серого вещества спинного мозга.
Развитие медленного позитивного сдвига потенциала коры зачастую сопровождается гиперполяризацией глиальных клеток, находящихся в месте регистрации суммарной поверхностной активности.
Развитие медленного позитивного сдвига потенциала коры зачастую сопровождается гиперполяризацией глиальных клеток, находящихся в месте регистрации суммарной поверхностной активности.
Сведения о роли глиальных клеток в процессах развития нервной системы касаются отдельно участия макро- и микроглии в центральной и шванновских клеток в управлении ростом аксона и формировании нервных волокон в периферической нервной системе.
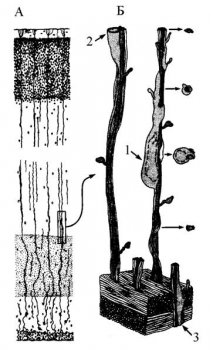
Рис. 6. Миграция нейронов вдоль радиальной глии в процессе развития.
А – срез затылочной доли развивающейся коры плода обезьяны.
Б. – 1, 2, 3 – нервные клетки на разных фазах миграции (Николс и др., 2003).
В коре больших полушарий и мозжечка на ранних стадиях эмбриогенеза миграция нейронов связывается с наличием радиальной структуризацией глиальных клеток. По мере развития и утолщения нервной трубки глиальные клетки удлиняются, образуя своеобразную «этажерку» (по Ракичу). Нейроны мигрируют вдоль радиальных элементов «этажерки», достигая своего места в пределах корковой пластинки. Методами иммунологического анализа показано, что нервные и глиальные клетки при этом выделяют различные белки, управляющие миграцией нейронов и воздействующие на навигацию конуса роста аксона, направляя его к клеткам-мишеням. Среди них астротактин, ламинин, агрин, Ф-спондин и фибронектин (последние контролируют миграцию клеток нервного гребешка), участвующие также в формировании нервно-мышечных синапсов. В последнее время установлена особая роль белка агрина в процессе формирования нервно-мышечных синапсов.
Рис. 6. Миграция нейронов вдоль радиальной глии в процессе развития.
А – срез затылочной доли развивающейся коры плода обезьяны.
Б. – 1, 2, 3 – нервные клетки на разных фазах миграции (Николс и др., 2003).
В коре больших полушарий и мозжечка на ранних стадиях эмбриогенеза миграция нейронов связывается с наличием радиальной структуризацией глиальных клеток. По мере развития и утолщения нервной трубки глиальные клетки удлиняются, образуя своеобразную «этажерку» (по Ракичу). Нейроны мигрируют вдоль радиальных элементов «этажерки», достигая своего места в пределах корковой пластинки. Методами иммунологического анализа показано, что нервные и глиальные клетки при этом выделяют различные белки, управляющие миграцией нейронов и воздействующие на навигацию конуса роста аксона, направляя его к клеткам-мишеням. Среди них астротактин, ламинин, агрин, Ф-спондин и фибронектин (последние контролируют миграцию клеток нервного гребешка), участвующие также в формировании нервно-мышечных синапсов. В последнее время установлена особая роль белка агрина в процессе формирования нервно-мышечных синапсов.
Питательная функция глии была предположена Гольджи, исходя из структурных соотношений нервных и глиальных клеток и соотношения последних с капиллярами мозга. Отростки протоплазматических астроцитов (сосудистые ножки) тесно контактируют с базальной мембраной капилляров, покрывая до 80% их поверхности. Трофическая функция глиальных клеток осуществляется либо одним астроцитом (сосудистая ножка ножка на капилляре а другие отростки – на нейроне), либо через систему астроцит – олигодендроцит – нейрон. Показано также что глиальные клетки принимают участие в образовании гемато-энцефалического барьера, обеспечивающего, как известно, селективный перенос веществ из крови в нервную ткань. Однако, следует отметить, что существенная роль глиальных клеток в функционировании гемато-энцефалического барьера признается не всеми исследователями (А.И.Ройтбак, 1979).
В работах Глобуса (1973) и других авторов обнаружено, что некоторые меченые аминокислоты, инъецированные путём электрофореза через микроэлектрод в глиальные клетки пиявки довольно быстро обнаруживались в цитоплазме рядом расположенных нейронов. Предполагается, что клетки глии способны выделять в межклеточное пространство низкомолекулярные соединения и белки, которые могут инкорпорироваться в цитоплазму соседних нейронов. Длительная активация нейронов приводит к к увеличению числа перинейрональных сателлитов, перемещающихся в область высокой нейрональной активности. Это показано при активации мотонейронов спинного мозга, при электрической стимуляции поверхности коры больших полушарий, при анализе гистологической картины зрительной коры крысы в условиях адекватной активации зрительной функции (нахождение в условиях сенсорно обогащенной внешней среды по сравнению с условиями частичной депривации). В симпатических ганглиях нарастание числа клеток-сателлитов наблюдается через десятки минут после стимуляции афферентных волокон, в то время как в коре полушарий этот период исчисляется десятками секунд. Это позволяет предположить, что олигодендроциты в коре обладают большей реактивностью.
В работах Глобуса (1973) и других авторов обнаружено, что некоторые меченые аминокислоты, инъецированные путём электрофореза через микроэлектрод в глиальные клетки пиявки довольно быстро обнаруживались в цитоплазме рядом расположенных нейронов. Предполагается, что клетки глии способны выделять в межклеточное пространство низкомолекулярные соединения и белки, которые могут инкорпорироваться в цитоплазму соседних нейронов. Длительная активация нейронов приводит к к увеличению числа перинейрональных сателлитов, перемещающихся в область высокой нейрональной активности. Это показано при активации мотонейронов спинного мозга, при электрической стимуляции поверхности коры больших полушарий, при анализе гистологической картины зрительной коры крысы в условиях адекватной активации зрительной функции (нахождение в условиях сенсорно обогащенной внешней среды по сравнению с условиями частичной депривации). В симпатических ганглиях нарастание числа клеток-сателлитов наблюдается через десятки минут после стимуляции афферентных волокон, в то время как в коре полушарий этот период исчисляется десятками секунд. Это позволяет предположить, что олигодендроциты в коре обладают большей реактивностью.
В центральной нервной системе соотношение нейронов и глиальных клеток составляет 1 к 10, т.е. нейроны весьма плотно окружены глиальными клетками. Мембраны нейронов и глиальных клеток не входят в тесный контакт, между ними имеется пространство не менее 20 нм. Не найдено структур, указывающих на наличие ни химических, ни электрических синапсов между ними, в связи с этим прямое электрическое взаимодействие между глиальными и нервными клетками отрицается. При этом достаточно четко показано, что активность нейронов влияет на уровень потенциала глиальных клеток. Микроэлектродные исследования последних лет прояснили механизм таких влияний.
Возникновение и распространение потенциала действия по мембране тела нейрона и его отросткам приводит, как известно, к выходу калия в окружающую среду. Повышение калиевой проводимости мембраны нейрона достигает максимума приблизительно через 1 мс от начала развития потенциала действия (т.е. на фазе его завершения) и медленно снижается в течение 2-3 мс. Если же потенциалы действия следуют с высокой частотой, то создаются условия для пропорционального нарастания концентрации калия в межклеточном пространстве в непосредственной близости от возбуждённой мембраны. Следует ожидать, что и ответ глиальной клетки-сателлита будет зависеть от степени возбуждения нейрона. Подтверждение этому были найдены в разнообразных и многочисленных экспериментах. В частности, в работах Николса и Каффлера (1979) на глиальных клетках зрительного нерва протея обнаружено, что при одиночном раздражении нерва деполяризация развивалась в течение 150 мс, после чего мембрана глиальной клетки медленно восстанавливала заряд. При частоте стимуляции 1/с имела место суммация сдвигов потенциала мембраны, а при частоте 5/с и выше достигалось плато развития потенциала уровня 50 мВ.
Возникновение и распространение потенциала действия по мембране тела нейрона и его отросткам приводит, как известно, к выходу калия в окружающую среду. Повышение калиевой проводимости мембраны нейрона достигает максимума приблизительно через 1 мс от начала развития потенциала действия (т.е. на фазе его завершения) и медленно снижается в течение 2-3 мс. Если же потенциалы действия следуют с высокой частотой, то создаются условия для пропорционального нарастания концентрации калия в межклеточном пространстве в непосредственной близости от возбуждённой мембраны. Следует ожидать, что и ответ глиальной клетки-сателлита будет зависеть от степени возбуждения нейрона. Подтверждение этому были найдены в разнообразных и многочисленных экспериментах. В частности, в работах Николса и Каффлера (1979) на глиальных клетках зрительного нерва протея обнаружено, что при одиночном раздражении нерва деполяризация развивалась в течение 150 мс, после чего мембрана глиальной клетки медленно восстанавливала заряд. При частоте стимуляции 1/с имела место суммация сдвигов потенциала мембраны, а при частоте 5/с и выше достигалось плато развития потенциала уровня 50 мВ.
Микроэлектродные исследования клеток глии на разных объектах выявили наличие у них мембранного потенциала покоя, который может достигать уровня 90 мв. Высказано предположение, что олигодендроциты в целом имеют более выраженный потенциал покоя по сравнению с астроцитами. Следует отметить, что разные авторы отмечают широкий разброс уровня поляризации мембраны глиальных клеток – от 20 до 90 мв, что связано, по-видимому, с тем, что уровень заряда мембраны глиальной клетки есть единственный показатель уровня её активности. Надо думать, что, фиксируя тот или иной уровень заряда, исследователи имели дело с клетками, находящимися в разном состоянии. Кардинальное различие нейронов и клеток глии заключается в том, что глиальные клетки реагируют на внешние воздействия изменением уровня мембранного потенциала без генерации потенциала действия, как это имеет место у нейронов. Показано, что поляризация глиальной клетки через внутриклеточный микроэлектрод, деполяризующая мембрану в широких пределах – от 20 до 200 мв и даже до нулевого уровня никогда не приводит к появлению разрядов. Таким образом, мембрана глиальной клетки электрически пассивна. В последнее время на мембранах глиальных клеток выявлено наличие многочисленных ионных каналов. Среди них доминируют калиевые, имеются потенциалзависимые натриевые и кальциевые каналы, описаны хлорные каналы. На мембранах клеток глии имеются многочисленные рецепторы к нейромедиаторам, в мембрану встроены транспортёры глутамата, ГАМК и глицина (Мартини с соавт., 1997). При этом механизм генерации потенциала действия в глиальных клетках отсутствует. Как показали исследования многих авторов, уровень заряда мембраны глиальной клетки зависит в первую очередь от концентрации ионов калия в окружающей клетку среде. Определённый вклад в формирование потенциала мембраны вносят ионы натрия и, возможно, другие ионы и сложные химические агенты межклеточного пространства. Для шванновских клеток решающим является, по-видимому, только концентрация ионов калия.
Миелиновая оболочка, окружающая нервное волокно обладает изолирующими свойствами, что создаёт условия независимости протекания возбуждения по отдельным волокнам. Было обнаружено, что порог раздражения одиночного нервного волокна лягушки существенно различается при приложении раздражающего микроэлектрода к участку волокна в области перехвата Ранвье и к межперехватному участку, покрытому миэлином. В области перехвата он наименьший, в межперехватном участке – максимальный. При этом пороги раздражения снижались для области перехвата в 5-7 раз. В состоянии покоя, как показали расчёты, плотность тока, проходящего через мембрану в перехвате Ранвье в тысячи раз больше, чем в миелинизированном участке. Объяснение этому кроется в организации миелиновой оболочки – многослойной ламеллярной структуре, богатой липидами (до 70-85 % сухого веса), в частности сфингомиелинами и галактоцереброзидами и гидрофобными белками. Миелиновая оболочка обладает также особыми емкостными характеристиками. Так, у миелинизированных нервных волокон скорость пассивных изменений мембранного потенциала на порядок и более выше, чем у безмякотных аксонов, при том. что ёмкость мембраны у тех и других волокон примерно одинакова и составляет 1-2 мкФ/см2, что соответствует показателю лишь одной ламеллы, количество которых, как уже указывалось, может достигать нескольких десятков. Согласно Ходжкину миелиновая оболочка нервного волокна лягушки толщиной 2 мкм характеризуется ёмкостью на единицу площади порядка 0,025 – 0,005 мкФ/см2 и ведет себя подобно конденсатору с утечкой (Тасаки).
Миелиновая оболочка нервных волокон в центральной нервной системе образуется отростками олигодендроцитов. Как правило, миелиновыми оболочками покрыты аксоны, иногда обнаруживаются миелинизированные дендриты и, как редкое исключение – клеточные тела. Отростки олигодендроцитов, окружая нервные волокна, образуют мезаксон, который вращается вокруг них, образуя ламеллы. Мезаксон имеет пятислойную структуру: белок-липид-белок-липид-белок. Эта структура ,многократно закручиваясь вокруг аксона, конденсируется в компактную миелиновую оболочку. На электронных микрофотографиях миелин представляет собой серию чередующихся липидных и белковых слоёв, число которых может достигать у крупных аксонов 100 и более. Сплав цитоплазматических поверхностей мембраны олигодендроцита образует темную линию (главный период), а сплав экстраклеточных поверхностей – половинный или промежуточный период (более светлая линия). Повторяющийся период миелина определяется толщиной составляющего его липидного бислоя, расположенного между двумя белковыми слоями. Из всех биологических мембран миелин имеет самое низкое содержание воды и самое высокое отношение липидов к белку. Здесь белки составляют 15-30 %, а липиды – 70-85 % сухой массы. Липиды и белки миелина обладают высокой гидрофобностью, что определяет свойство миелина как электроизолятора.
В отличие от периферических нервных волокон, где один сегмент миелиновой оболочки представлен одной шванновской клеткой (см. выше), миелиновая оболочка одного сегмента нервных волокон в центральной нервной системе образуется, как правило, отростками нескольких близлежащих олигодендроцитов. С другой стороны, показано, что отростки одного олигодендроцита могут участвовать в образовании миелинового футляра для нескольких волокон. Толщина миелиновой оболочки в волокнах центральной нервной системы обычно невелика и количество ламелл редко достигает нескольких десятков и сотен. Миелинизируются даже очень тонкие волокна – от 0,3 мкм в диаметре. В целом, при одинаковом диаметре аксона, миелиновые оболочки в центральной нервной системе тоньше, чем в периферической, при этом сохраняется правило – чем тоньше волокно, там короче миелиновые сегменты.
В отличие от периферических нервных волокон, где один сегмент миелиновой оболочки представлен одной шванновской клеткой (см. выше), миелиновая оболочка одного сегмента нервных волокон в центральной нервной системе образуется, как правило, отростками нескольких близлежащих олигодендроцитов. С другой стороны, показано, что отростки одного олигодендроцита могут участвовать в образовании миелинового футляра для нескольких волокон. Толщина миелиновой оболочки в волокнах центральной нервной системы обычно невелика и количество ламелл редко достигает нескольких десятков и сотен. Миелинизируются даже очень тонкие волокна – от 0,3 мкм в диаметре. В целом, при одинаковом диаметре аксона, миелиновые оболочки в центральной нервной системе тоньше, чем в периферической, при этом сохраняется правило – чем тоньше волокно, там короче миелиновые сегменты.
В процессе роста периферических нервов, их навигации и достижения клеток-мишений вслед за удлиняющимся аксоном мигрируют шванновские клетки. Последние, следуя за растущим аксоном, удлиняются и активно делятся. С началом миелинизации шванновские клетки активируются, их цитоплазма резко гипертрофируется, в ней появляются зернистые включения, содержащие фосфолипиды. На начальном этапе пролифирирующие шванновские клетки располагаются тяжами вокруг пучков нервных волокон. В последующем глиальные клетки проникают внутрь пучков, разделяя их и по завершению процесса миелинизации каждое нервное волокно оказывается окруженным глиальным футляром. Очень редко шванновская клетка может окружать два и более отдельных волокна.
Процесс образования миелиновой оболочки хорошо изучен в культуре нервной ткани путем прижизненной световой и электронной микроскопии и состоит в следующем. В процессе развития аксон погружается в желобок на поверхности шванновской клетки. Далее края желобка смыкаются, при этом образуется двойная складка плазмолеммы – мезаксон. Мезаксон удлиняется, спирально вращается вокруг нервного волокна, образуя всё новые и новые витки – ламеллы. Формируется рыхлая миелиновая оболочка. Одновременно с образованием мезаксона по спирали вращается и шванновская клетка с ядром. По мере созревания миелина цитоплазма, находящаяся между слоями мезаксона вытесняется, так что по окончании процесса миелинизации она остаётся лишь на внутренней и наружной поверхности миелиновой оболочки. Ядро при этом оказывается в наружном пространстве цитоплазмы миелиновой оболочки. В цитоплазме сохраняется полный набор клеточных органелл. Миелиновая оболочка составляет около 20-40 % общего диаметра миелинизированного волокна.
Процесс образования миелиновой оболочки хорошо изучен в культуре нервной ткани путем прижизненной световой и электронной микроскопии и состоит в следующем. В процессе развития аксон погружается в желобок на поверхности шванновской клетки. Далее края желобка смыкаются, при этом образуется двойная складка плазмолеммы – мезаксон. Мезаксон удлиняется, спирально вращается вокруг нервного волокна, образуя всё новые и новые витки – ламеллы. Формируется рыхлая миелиновая оболочка. Одновременно с образованием мезаксона по спирали вращается и шванновская клетка с ядром. По мере созревания миелина цитоплазма, находящаяся между слоями мезаксона вытесняется, так что по окончании процесса миелинизации она остаётся лишь на внутренней и наружной поверхности миелиновой оболочки. Ядро при этом оказывается в наружном пространстве цитоплазмы миелиновой оболочки. В цитоплазме сохраняется полный набор клеточных органелл. Миелиновая оболочка составляет около 20-40 % общего диаметра миелинизированного волокна.
Аксоны и некоторые дендриты нейронов зрелой нервной системы, начиная от аксонного холмика до конечных ветвлений покрыты футляром из нейроглиальных элементов. В большинстве случаев они формируют миелиновую оболочку (центральная нервная система и периферические соматические нервы). Постганглионарные вегетативные волокна также покрыты футляром их глиальных клеток,без образования миелина. Отсюда разделение волокон на миелинизированные (мякотные) и немиелинизированные (безмякотные). Миелиновая оболочка формируется в разных отделах нервной системы из разных клеток нейроглии. Так, в центральной нервной системе это олигодендроциты, а в периферической – шванновские клетки. Глиальный футляр теряется только лишь в конечных участках разветвлений аксонов – в области пресинаптических окончаний. Длина таких обнаженных (голых) участков аксона не превышает 20-30 мкм, чаше всего это лишь несколько мкм. Как известно, наличие миелиновой оболочки нервного волокна обеспечивает особый характер распространения по нему нервного импульса - сальтаторность, большую скорость распространения, отсутствие затухания процесса распространения возбуждении по длине волокна.
Микроглиоциты – клетки мезенхимального происхождения впервые были подробно изучены Hortega в 30-х годах 20 века и часто называются его именем. Микроглия эмбрионально связана с мягкими мозговыми оболочками и сосудами и, «по-видимому, без капилляров и нейронов не существует» (А.Л.Микеладзе, Э.И.Дзамоева, 1965). На ранней стадии развития микроглиоциты относят к блуждающим клеткам. Они мигрируют вдоль нервных волокон и кровеносных сосудов. Вначале микроглиоциты имеют округлую форму, в период миграции выпускают псевдоподии, а по окончании рассеивания в нервной системе приобретают вид многоотросчатых (мохнатых) клеток (Рис.1).
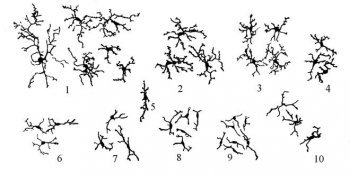
Рис. 1. Микроглия различных участков ЦНС обезьяны. (по Микеладзе и Дзамоевой, 1965).
1. – затылочная кора
2. – верхние бугры четверохолмия
3, 4, 5, 8 – спинной мозг
6. –ядро Эдингер-Вестфаля
7. – гопоталамус (вентролатеральное ядро)
9. – центральное серое вещество
10 – зрительный бугор
Форма тела зрелых клеток разнообразна - треугольная, веретенообразная, шаровидная. От тела клетки отходят 2-5 отростков, которые обильно ветвятся и имеют многочисленные мелкие выросты – шипики, количество последних увеличивается по мере удаления от клеточного тела.
Рис. 1. Микроглия различных участков ЦНС обезьяны. (по Микеладзе и Дзамоевой, 1965).
1. – затылочная кора
2. – верхние бугры четверохолмия
3, 4, 5, 8 – спинной мозг
6. –ядро Эдингер-Вестфаля
7. – гопоталамус (вентролатеральное ядро)
9. – центральное серое вещество
10 – зрительный бугор
Форма тела зрелых клеток разнообразна - треугольная, веретенообразная, шаровидная. От тела клетки отходят 2-5 отростков, которые обильно ветвятся и имеют многочисленные мелкие выросты – шипики, количество последних увеличивается по мере удаления от клеточного тела.