Типы каталитических процессов:
1) кислотный катализ – внедрение протона в субстрат;
2) щелочной катализ – отрыв протона от субстрата;
3) электрофильний катализ – внедрение электрона в субстрат;
4) нуклеофильний катализ – отрыв электрона от субстрата.
Эти процессы ведут к ослаблению связей, что облегчает прохождение химической реакции.
1) кислотный катализ – внедрение протона в субстрат;
2) щелочной катализ – отрыв протона от субстрата;
3) электрофильний катализ – внедрение электрона в субстрат;
4) нуклеофильний катализ – отрыв электрона от субстрата.
Эти процессы ведут к ослаблению связей, что облегчает прохождение химической реакции.
Механизм действия ферментов. Считается, что взаимодействие фермента и субстрата происходит по закону комплементарности. То есть конформация активного центра фермента должна соответствовать конфигурации субстрата (они подходят друг другу как ключ к зам ку). Позже была предложена теория «индуцированного» соответствия – замок формируется только в момент приближения субстрата к активному центру фермента. В процессе взаимо действия субстрата с ферментом выделяют 5 этапов:
1) присоединение фермента к субстрату и образование ферментсубстратного комплекса;
2) квантово–механические сдвиги, которые приводят к ослаблению связей;
3) разрыв или образование связей;
4) образование новых связей ведет к образованию продукта реакции, конфигурация которого уже не соответствует активному центру фермента;
5) освобождение продуктов реакции от фермента.
1) присоединение фермента к субстрату и образование ферментсубстратного комплекса;
2) квантово–механические сдвиги, которые приводят к ослаблению связей;
3) разрыв или образование связей;
4) образование новых связей ведет к образованию продукта реакции, конфигурация которого уже не соответствует активному центру фермента;
5) освобождение продуктов реакции от фермента.
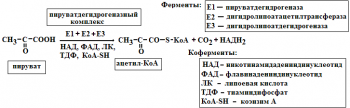
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
Изоферменты. Часть ферментов состоят не из одной белковой цепочки, а из нескольких субъединиц. Изоферменты – это семейство ферментов, которые катализируют одну и ту же реакцию, но отличаются по строению и физикохимическим свойствам. Например: лактатде гидрогеназа (ЛДГ) состоит их 4 субъединиц 2хтипов: субъединица Н, выделенная из сер дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus – мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различ ные формы ЛДГ с различным набором субъединиц. Известно 5 изоферментов ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени. Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повыше ние активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы (инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и повреждении скелетных мышц. То есть благодаря изоферментам можно определить локали зацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда явля ется повышение в крови сердечного изофермента креатинкиназы.
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени. Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повыше ние активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы (инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и повреждении скелетных мышц. То есть благодаря изоферментам можно определить локали зацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда явля ется повышение в крови сердечного изофермента креатинкиназы.
Химическая природа и структура ферментов. Большинство ферментов имеют белко вую природу, но ферментативной активностью обладает также иРНК (работы Томаса Чека).
Доказательства белковой природы ферментов таковы: а) потеря активности при кипя чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из ами нокислот (впервые так была синтезирована рибонуклеаза).
Структураферментов. Ферменты делятся на простые и сложные. Простые ферменты явля ются белками и состоят только из аминокислот (например, ферменты 3 класса гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак тора). Кофактор может быть неорганической (металлы) и органической природы и в зависи мости от прочности связи с апоферментом делятся на простетические группы (прочно, ко валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апофер ментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом.
Доказательства белковой природы ферментов таковы: а) потеря активности при кипя чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из ами нокислот (впервые так была синтезирована рибонуклеаза).
Структураферментов. Ферменты делятся на простые и сложные. Простые ферменты явля ются белками и состоят только из аминокислот (например, ферменты 3 класса гидролазы). Сложные ферменты состоят из белкового компонента (апофермента) и небелкового (кофак тора). Кофактор может быть неорганической (металлы) и органической природы и в зависи мости от прочности связи с апоферментом делятся на простетические группы (прочно, ко валентно связаны с апоферментом) и коферменты (слабо, нековалентно связаны с апофер ментом). В целом сложный фермент (апофермент + кофактор) называется холоферментом.
1. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы.
Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз).
Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов.
Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз).
Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов.
Центры ферментов: Молекула фермента взаимодействует с субстратом не всей своей по верхностью, а определенными участками. На поверхности фермента различают:
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
Активныйцентр – это участок фермента, который взаимодействует с субстратом. Ак тивных центров может быть 2, 4, 6, 8, в каждый входят 715 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
Свойства ферментов как биокатализаторов:
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера (лактатдегидрогеназа превращает только Lлактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом хи мической связи (один фермент – одна связь). Пример пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реак ции, как и все химические реакции, ускоряются при повышении температуры (в 24 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурныйопти мум, превышение которого приводит к понижению активности ферментов изза тепловой денатурации их молекул. Для большинства ферментативных реакций температурный опти мум 3840оС, а при 5060оС и выше скорость ферментативных реакций сильно уменьшается изза разрушения молекул фермента (искл. миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Фер менты лучше сохраняются при низких температурах – их активность снижается, но денату рации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
Принципы определения активности ферментов:
по скорости исчезновения субстрата;
по скорости накопления продуктов реакции.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
В медицинской энзимологии активность фермента выражают в единицах (U) на 1 л био логической жидкости (сыворотки крови, мочи.): U/л
по скорости исчезновения субстрата;
по скорости накопления продуктов реакции.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
В медицинской энзимологии активность фермента выражают в единицах (U) на 1 л био логической жидкости (сыворотки крови, мочи.): U/л
Ферменты располагаются в субклеточных структурах (органеллах) соответственно их функциям. Например: а) в ядре содержатся ферменты преобразования нуклеиновых кислот; б) во внутренней мембране митохондрий – ферменты дыхательной цепи; в) в лизосомах – гидролазы; г) в цитоплазме – ферменты гликолиза, синтеза жирных кислот; д) в матриксе митохондрий – ферменты ЦТК, окислительного декарбоксилирования αкетокислот, β– окисления жирных кислот; е) плазматическая мембрана содержит ферменты транслоказы, которые переносят через мембрану ионы Nа+, К+, глюкозу, аминокислоты и т.д.
Классификация ферментов (построена по типу химических реакций):
1.класс – оксидоредуктазы: катализируют окислительновосстановительные процессы (дегидрогеназы, оксидазы, цитохромы).
2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы).
3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы).
4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы).
5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомеразы).
6.класс–лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФсинтаза, пируваткарбоксилаза).
1.класс – оксидоредуктазы: катализируют окислительновосстановительные процессы (дегидрогеназы, оксидазы, цитохромы).
2.класс – трансферазы: катализируют реакции переноса химических групп, название берут от группы, которую переносят (метилтрансферазы, сульфотрансферазы, аминотрансферазы, фосфотрансферазы, ацилтрансферазы).
3.класс – гидролазы: катализируют реакции гидролиза, т.е. расщепление субстрата с участи ем воды (пептидазы, эстеразы, фосфатазы, гликозидазы).
4.класс – лиазы: катализируют реакции расщепления ковалентных связей между атомами C, O, N, S негидролитическим путем (декарбоксилазы, альдолазы, дегидратазы).
5.класс – изомеразы: катализируют реакции изомеризации (эпимеразы, рацемазы, изомеразы).
6.класс–лигазы: (синтетазы) катализируют реакции синтеза молекул за счет энергии АТФ (АТФсинтаза, пируваткарбоксилаза).
Номенклатура ферментов принята V Международным конгрессом биохимиков (1961).
1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «аза». Например: LЛактат:НАД+ оксидоредуктаза.
2. Рабочая номенклатура. Название фермента образуется из химического названия субстра та с добавлением суффикса «аза» либо из названия химического превращения субстрата с добавлением суффикса «аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа это рабочее название фермен та LЛактат:НАД+ оксидоредуктазы.
3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со стоящий из 4х цифр, которые обозначают: 1класс, 2подкласс, 3подподкласс, 4порядковый номер фермента в подподклассе. Например: 1.1.1.27 лактатдегидрогеназа, которая относит ся к I классу – оксидоредуктазам.
1. Систематическая номенклатура. Название фермента включает: химическое название субстрата; тип химической реакции (в соответствии с международной классификацией ферментов); суффикс «аза». Например: LЛактат:НАД+ оксидоредуктаза.
2. Рабочая номенклатура. Название фермента образуется из химического названия субстра та с добавлением суффикса «аза» либо из названия химического превращения субстрата с добавлением суффикса «аза». Например: lipos (жир), фермент катализирующий его превращение называется «липаза». Лактатдегидрогеназа это рабочее название фермен та LЛактат:НАД+ оксидоредуктазы.
3. Тривиальное (исторически сложившиеся) название. Не дает представления о субстрате или типе химического превращения. Пример пепсин, тромбин, трипсин, ренин. Согласно систематической номенклатуре каждому ферменту был дан код (шифр), со стоящий из 4х цифр, которые обозначают: 1класс, 2подкласс, 3подподкласс, 4порядковый номер фермента в подподклассе. Например: 1.1.1.27 лактатдегидрогеназа, которая относит ся к I классу – оксидоредуктазам.