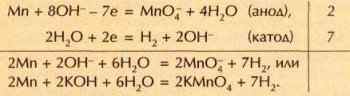Технеций и рений были открыты значительно позже марганца, хотя существование элементов с порядковыми номерами 43 и 75 предсказал ещё
Д. И. Менделеев. Он дал им названия «экамарганец» и «двимарганец», что означает «первый и второй аналоги марганца». Однако судьба распорядилась так, что сначала выделили «второй марганец» и лишь потом — «первый». Честь открытия двимарганца принадлежит немецким учёным Вальтеру Ноддаку (1892—1960) и Иде Такке (в замужестве Ноддак; 1896— 1978), обнаружившим в 1925 г. его следы в минералах редкоземельных элементов.
Они назвали новый элемент рением, желая увековечить тем самым имя родины Такке — Рейнской провинции. К 1926 г. им удалось выделить всего... 2 мг металла!
В 1928 г. после переработки 660 кг молибденита MoS2 был получен первый грамм рения, стоимость которого составила свыше 30 000 золотых марок! Но уже к 1930 г. количество добытого рения стало исчисляться килограммами, цена же его упала до 13 марок за грамм, а к 1935 г. — до 6,5 марок.
Предсказанный Менделеевым экамарганец в течение многих лет оставался для химиков загадкой, элементом-«невидимкой». Его ошибочно открывали много раз, и лишь в 1937 г. элемент № 43 был синтезирован в циклотроне (ускорителе частиц) при облучении молибдена ядрами дейтерия. Само название, которое технеций получил спустя десять лет, говорит о том, что он искусственный, созданный руками человека. Теперь технеций в большом количестве (сотни килограммов) получают из продуктов деления урана в ядерных реакциях.
Все изотопы технеция радиоактивны, и время их жизни относительно невелико (лишь у некоторых изотопов — 97Тс, 98Тс — период полураспада составляет величину порядка 106 лет), поэтому в природе его соединения практически отсутствуют.
Металлический технеций при комнатной температуре устойчив к окислению, не корродирует в морской воде. Одним словом, у него много достоинств. А вот радиоактивность и высокая стоимость металла — главные недостатки, которые препятствуют его практическому использованию.
Перманганат калия — очень сильный окислитель. Он может реагировать со многими неорганическими и органическими соединениями. Чем больше электронов способен принять окислитель в ходе реакции, тем большее количество молей другого вещества он окислит. Число электронов, переходящих к окислителю, зависит от условий проведения реакции, например от кислотности среды. Так, в нейтральной или слабощелочной среде перманганат-ион восстанавливается до оксида марганца (IV): MnО4+2Н2О+3е=MnО2+4ОН-. Но особенно ярко окисляющая способность перманганата проявляется в кислой среде: MnО-4+8Н++5е=Mn2++4Н2О. Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, сильно загрязнённой плохо смываемыми остатками органических веществ.
В домашних условиях тоже можно использовать перманганат калия (марганцовку) для пользы дела, например чтобы почистить фаянсовую раковину в ванной. Вообще-то есть специальные порошки и пасты, но будет неплохо, если юный химик докажет, что результатом его домашних опытов могут стать не только прожжённые брюки и пятна на полу.
В промышленности перманганат калия (марганцовку) получают электролизом концентрированного раствора гидроксида калия с марганцевым анодом. В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы. На катоде происходит выделение водорода. Схему электролиза можно представить в виде уравнений реакций:
Умеренно растворимый в воде перманганат калия выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить NaMnO4 невозможно: в отличие от перманганата калия, он прекрасно растворим в воде (при 20 °С его растворимость составляет 144 г на 100 г воды).
В течение долгого времени белую магнезию MgCO3 и чёрную магнезию (пиролюзит) MnO2 считали минералами, содержащими один и тот же металл. Потом из-за внешнего сходства чёрной магнезии и магнитного железняка Fe3O4 стали полагать, что чёрная магнезия — минерал железа. Первое серьёзное научное исследование, проведённое К В. Шееле в 1774 г., показало, что в состав этого вещества входит новый элемент. В том же году Ю. Ган, восстановив чёрную магнезию углём, выделил его в виде простого вещества. Сначала элемент назвали Magnesium (от старинного латинского названия пиролюзита lapis magnesis, затем переименовали в Manganesium). И лишь когда Г. Дэви выделил новый металл магний (Magnesium), во избежание путаницы с марганцем название последнего изменили на Manganum.
Марганец недаром считается химическим хамелеоном: известно большое число соединений, в которых он проявляет все промежуточные степени окисления от 0 до +7. А окраска этих соединений составляет богатейшую палитру: соли марганца(П) — нежного бледно-розового цвета, соединения марганца (III) — коричневые или вишнёвые, марганца (IV) — чёрные или коричневые, марганца (V) — ярко-синие, марганца (VI) — зелёные, а марганца (VII) — малиновые.
Когда через подкисленный раствор молибдата щелочного металла или аммония пропускают сернистый газ, выпадают интенсивно окрашенные синие осадки переменного состава, которые часто выражают формулой Мо5O14 и называют молибденовой синью:
5К2Мo+6О4+SO2+8HCl=Мо+5,+65О14+K2SO4+8KCl+4Н2О.
Эта реакция используется при окрашивании тканей. Если ткань пропитать раствором молибдата аммония, а затем подействовать восстановителем (сернистым газом или раствором дихлорида олова), то она окрашивается в разные оттенки синего цвета — в зависимости от концентрации восстановителя. Часть атомов молибдена в «сини» восстановлена до +5, поэтому степень окисления оказывается нецелочисленной.
В традиционном понимании бронза — это сплав меди с оловом. Но есть и другие бронзы — вольфрамовые, которые представляют собой сложные оксиды обшей формулы NaxWO3. В зависимости от значения х их цвет может меняться от голубого (при 0,3<х<0,45) через фиолетовый (0,45<х<0,6) до красного и золотисто-жёлтого (0,6<х<0,9).
Вольфрамовые бронзы получают, восстанавливая вольфраматы водородом. Так, при нагревании тривольфрамата натрия в атмосфере водорода до 600 °С образуются кристаллы золотистого цвета: Na2W3O10+Н2=3Na0,667WO3+Н2О.
(1742—1786)
Гордость шведской науки Карл Вильгельм Шееле по происхождению немец. О его детских годах мало что известно. Пятнадцати лет от роду он стал учеником аптекаря в Гётеборге. Занимаясь приготовлением лекарств, Шееле основательно изучил химию. В то время, когда она только начинала оформляться в самостоятельную научную дисциплину, деятельность многих выдающихся исследователей протекала именно в аптеках. При них существовали неплохо оборудованные лаборатории, а в библиотеках хранилось немало полезных книг и руководств.
Все свои исследования Шееле проводил в аптеках, переезжая из одного города в другой. После Гётеборга он последовательно работал в Мальмё, Стокгольме, Упсале, Чёпинге. Когда учёный находился в зените славы, прусский король Фридрих II предложил ему должность профессора химии в Берлинском университете. Шееле ответил отказом.
Чёрные с металлическим блеском кристаллы дисульфида молибдена MoS2 были известны людям ещё в древности. Это вещество нередко пугали с графитом или с галенитом PbS. Название минерала — «молибденит» — подчёркивало сходство его механических свойств со свойствами свинца (в переводе с греческого «молибдос» означает «свинец»): им можно было пользоваться для письма по пергаменту. В 1778 г. К. В. Шееле доказал, что в молибдените не содержится свинца, и выделил из него оксид нового элемента. Спустя несколько лет шведский химик П. Хьельм, прокаливая этот оксид с углём, получил металл. По содержащему его минералу новый элемент и стали именовать молибденом.
Блестящие кристаллы молибденита MoS2 внешне похожи на свинцовый блеск PbS или графит.
Окраска солей хрома (III) может легко переходить из фиолетовой в зелёную и наоборот. Растворим в воде несколько фиолетовых кристалликов гексагидрата хлорида хрома CrCl3•6Н2О. При кипячении фиолетовый раствор этой соли становится зелёным. При выпаривании зелёного раствора образуется зелёный порошок того же состава, что и исходная соль. А если насытить охлаждённый до 0 °С зелёный раствор хлорида хрома хлороводородом, цвет его вновь станет фиолетовым.
Как объяснить наблюдаемое явление?
Это редкий в неорганической химии пример изомерии — существования веществ, имеющих одинаковый состав, но разные строение и свойства. В фиолетовой соли атом хрома связан с шестью молекулами воды, а атомы хлора являются противоионами: [Cr(Н2О)6]Cl3, в зелёном хлориде хрома они меняются местами: [Cr(Н2О)4Cl2]Cl•2Н2О.
Хром обнаружил в 1766 г. в «красной свинцовой руде» (минерале крокоите PbCrО4), привезённой с Урала, русский минералог И. Г. Леман. А в свободном виде металл впервые выделил в 1797 г. французский химик Луи Никола Воклен.
Хром — довольно распространённый элемент. В земной коре его содержится примерно столько же, сколько хлора и ванадия, — 0,02%. Среди минералов хрома преобладает хромовый железняк, или хромит, FeCr2O4. При его восстановлении углём образуется феррохром — сплав хрома с железом: FeCr2O4+4С=Fe+2Cr+4CO. Для получения чистого металла хромистый железняк очищают от железа, переводя хром в высшую степень окисления (+6), и лишь затем восстанавливают его алюминием.
Кластеры (англ. cluster — «гроздь») — это соединения, в которых несколько атомов металла объединены в «гроздь», т. е. связаны друг с другом химической связью. Если формально рассчитать степень окисления металла в кластерном соединении, то часто выходит дробное число. Например, ещё в начале XX в. было получено вещество состава Та6Сl14•7Н2О, в котором формальная степень окисления тантала равна 2,33. Позже удалось установить, что основной структурной единицей этого соединения является катион [Та6Сl12]2+.
с расплавленными щелочами, образуя соли — ниобаты (например, KNbO3) и танталаты (КТаО3).
Среди соединений ниобия низших степеней окисления наибольший интерес представляют германид ниобия Nb3Ge — вещество, сохраняющее сверхпроводимость вплоть до 24,5 К (что уступает только сверхпроводникам на основе керамик и некоторым производным фуллерена С60), и карбид ниобия NbC — термостойкое и пластичное вещество золотистого цвета, применяемое для создания прочных и в то же время красивых защитных покрытий.
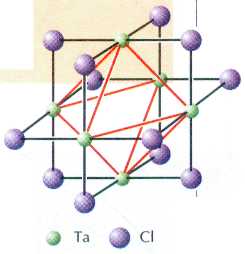
Строение катиона [Та6Cl12]2+.