Селитра — природные нитраты натрия и калия — была известна в Китае в первые века новой эры; её использовали для приготовления пороха и проведения фейерверков. Позже она упоминается в трудах европейских алхимиков (латинские названия — nitro или sal nitri). Нагревая селитру с железным купоросом — гептагидратом сульфата железа(П), — алхимики получали азотную кислоту, которая длительное время называлась по-латыни aqua fortis («крепкая вода»; в русских текстах обычно встречается термин «крепкая водка»):
4KNO3+2(FeSO4•7Н2О) ®t°Fe2O3+2K2SO4+2HNO3+2NO2+13H2O.
Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой):
KNO3+H2SO4 (конц)®t° KHSO4+HNO3.
Он же обнаружил, что при взаимодействии азотной кислоты с поташом К9СО3 образуется чистая калийная селитра. Это открытие имело большое практическое значение, ведь раньше селитру, необходимую для производства пороха, ввозили в Европу из стран Востока, а также выделяли из соляного налёта на стенах конюшен или из селитряных ям, где она образовывалась под действием микроорганизмов как конечный продукт окисления азотсодержащих органических соединений.
При прокаливании смеси селитры NaNO3, железного купороса FeSO4•7Н2О, алюмокалиевых квасцов KAl(SO4)2•12Н2О и нашатыря NH4Cl алхимикам удалось получить жидкость, растворявшую даже «царя металлов» — золото. Поэтому её и назвали aqua regia, что значит «царская вода» или «царская водка». Царская водка — жидкость жёлтого цвета, образующаяся при смешении трёх объёмов соляной и одного объёма азотной кислот. В царской водке без труда растворяется даже такой металл, как платина:
3Pt+18HCl+4HNO3=3H2[PtCl6]+4NO+8H2O.
Высокая окислительная способность царской водки обусловлена протеканием обратимой реакции с образованием сильных окислителей — атомарного хлора и хлорида нитрозила NOCl.
HNO3+3HCl «2[Cl]+2Н2О+NOCl.
Последний и придаёт жидкости жёлтый или жёлто-оранжевый цвет.
Азот независимо друг от друга открыли в конце XVIII в. несколько учёных. Английский исследователь Генри Кавендиш получил «мефитический воздух» (так он назвал азот), многократно пропуская воздух над раскалённым углём (тем самым удалялся кислород), а потом через раствор щёлочи для поглощения образовавшегося углекислого газа СО2.
Соотечественник Кавендиша Джозеф Пристли (1733—1804) описал образование газа, не поддерживающего горение и дыхание, — «флогистированного воздуха», — наблюдая за горением свечи в закрытом сосуде.

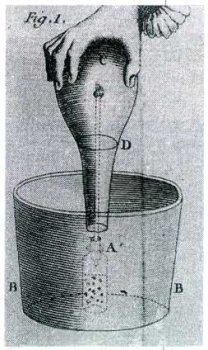
Получение азотной кислоты. Гравюра из книги Г. Агриколы «О горном деле и металлургии». Издание 1557 г. В круглое отверстие в верхней части печи В, имеющей вид стола, помешают глиняный сосуд со смесью купороса и селитры или квасцов и селитры. Сверху на сосуд надевают шлемовидную крышку Н с длинным носиком, который опушен в сосуд К, служащий приёмником кислоты.
Опыт Дж. Пристли по выделению азота из воздуха.
Жидкий азот.
Тройная связь в молекуле азота.

Наконец, ещё один английский учёный, Даниэль Резерфорд (1749— 1819), также получил азот из воздуха. В отличие от Кавендиша и Пристли, он сразу же, в 1772 г., опубликовал работу, где описал получение и свойства выделенного им «удушливого воздуха». Поэтому именно Резерфорд считается первооткрывателем азота. Данный пример очень поучителен для истории науки: приоритет в открытии принадлежит тому, кто быстрее опубликовал свои результаты.
В природе наибольшее количество азота находится в несвязанном виде в воздухе. Основной состав атмосферного воздуха определил А. Л. Лавуазье, по предложению которого новый элемент и назвали азотом. Название это составлено из греческого слова «зое»
(«жизнь») и приставки «а-» («не-») и означает «безжизненный», «не дающий жизнь». Латинское наименование азота — Nitrogenium — переводится как «образующий (рождающий) селитру». Редко встречаются содержащие азот минералы, например чилийская селитра NaNO3, залежи которой тянутся вдоль побережья Чили и Перу на расстояние свыше Зб00 км. В конце XIX в. добыча её составляла примерно 0,5 млн. тонн в год. Не случайно у предпринимателей и учёных возникали справедливые опасения в том, что скоро её запасы иссякнут. Это и подтолкнуло химиков к разработке технологий по связыванию азота воздуха.
Азот — газ без цвета, вкуса и запаха tпл=-210 °С, tкип=-196 °С), мало растворимый в воде (в 100 мл воды при 20 °С растворяется 1,54 мл азота). Свободный азот химически инертен из-за высокой прочности молекулы N2, в которой атомы связаны тройной связью. Поэтому азот с трудом вступает в химические реакции, не поддерживает горение (горящая лучинка в нём гаснет) и дыхание.
Аммиак. Это вещество наделено «ароматом», который, однажды узнав, не забудешь никогда! Стоит только откупорить пузырёк с нашатырным спиртом, как волна резкого запаха распространится по комнате.
Нашатырный спирт — это 10-процентный водный раствор аммиака NH3. При нормальных условиях аммиак — бесцветный газ, легко конденсирующийся в жидкость (tпл=-78 °С, tкип=-33 °С), очень хорошо растворимый в воде: при 20 °С в литре воды может быть растворено 702 л аммиака, а при 0 °С — 1176 л! Такая аномально высокая растворимость обусловлена образованием прочных водородных связей между молекулами воды и аммиака.
Раствор, содержащий аммиак, имеет щелочную реакцию среды, в чём легко убедиться, добавив в него фенолфталеин. Часть молекул NH3, находящихся в растворе в виде гидратов, взаимодействует с молекулами воды:
Роза, замороженная в жидком азоте, становится «стеклянной» — настолько хрупкой, что от удара по столу рассыпается в порошок.
*В человеческом организме содержится в среднем 1,8 кг азота.
**В лаборатории обычно используют концентрированный 25-процентный раствор NH3 (плотность 0,91 г/см3).
***Слово «аммиак» происходит от древнего названия нашатыря NH4Cl — sal ammoniac, который добывали в Ливии недалеко от святилища бога Амона.
NH3•H2O«NH4++ОН-. При этом в растворе накапливается некоторое, относительно небольшое, количество гидроксид-ионов, которые и вызывают появление окраски индикатора. Если сравнивать концентрацию ОН-ионов в растворах аммиака и, например, гидроксида натрия, то нашатырный спирт, безусловно, проигрывает -он является слабым основанием.
Аммиак — сильный восстановитель. В кислороде он горит, окисляясь до свободного азота (4NH3+3О2=2N2+6Н2О), а на платиновом катализаторе превращается в NO:
4NH3 +5О2®Pt 4NO+6Н2О.
В водном растворе аммиак легко восстанавливает бром до бромид-иона: 8NH3+3Br2=6NH4Br+N2.
При взаимодействии сухого аммиака либо галогенидов аммония с хлором, бромом или иодом образуются неустойчивые галогениды азота NCl3, NBr3 и NI3•nNH3 Чёрный порошок йодистого азота взрывается от малейшего прикосновения.
И Образующийся при восстановлении иона аммония радикал NH4 («металлический аммоний») неустойчив и распадается на NH3 и Н2.
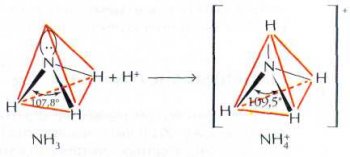
Молекула NH3 имеет форму треугольной пирамиды, внутри которой расположен атом азота, а в четырёх вершинах — три атома водорода и одна электронная пара. Угол Н—N—Н в молекуле аммиака (107,8°) близок к тетраэдрическому (т. е. углу правильной треугольной пирамиды). Присоединяя ион водорода Н+, она превращается в катион аммония NH4+, имеющий форму правильного тетраэдра.
ОКСИДЫ АЗОТА
Азот — один из немногих элементов, образующих большое число оксидов всех возможных степеней окисления — от +1 до +5, и каждый из них отличается своим особым «нравом». Оксид азота (I) N2O, или «веселящий газ», — бесцветный газ (tпл=-91 °C, tкип=-89°C, обладающий лёгким наркотическим действием.
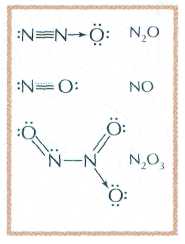
Образуется он при разложении нитрата аммония: NH4NO3 ®250°С N2O+2Н2О. Это соединение
проявляет слабые окислительные свойства: тлеющая лучинка вспыхивает в нём, как в кислороде.
Оксид азота(II) NO, как и N2O, не взаимодействует с щелочами и не образует никаких солей. NO представляет собой бесцветный газ (tпл=-164 °С, tкип=-152 °С), малорастворимый в воде. Его обычно получают, действуя на медь разбавленной азотной кислотой. На воздухе он легко окисляется до бурого оксида азота(IV) NO2. При охлаждении молекулы NO2 димеризуются, и газ конденсируется в жёлто-коричневую жидкость (tкип=21 °С), состоящую из молекул N2O4. Димерные молекулы N2O4 присутствуют и в газообразном NO2 вплоть до 140 °С; с повышением температуры их доля постепенно снижается.
При взаимодействии с водой или щёлочью оксид азота (IV) диспропорционирует:
2N+4O2+2NaOH=NaN+3O2+NaN+5O5+H2O.
Превращение NO в NO2. При снятии часового стекла NO начинает окисляться, превращаясь в бурый газ NO2. Через несколько секунд весь цилиндр заполняется бурым газом.
Оксид азота(III) N2O3 — красивая жидкость ярко-синего цвета (tпл=-101 °С, устойчива ниже -40 °С), образующаяся при взаимодействии равных объёмов NO и NO2. Соединяясь с водой, N2O3 даёт слабую азотистую кислоту HNO2, известную лишь в растворах, которые окрашены в голубой цвет.
Её соли, нитриты, применяют в производстве органических красителей, а также в пищевой промышленности, например при переработке мяса. Обработанное небольшим количеством нитрита натрия мясо надолго сохраняет свежий цвет. Нитрит взаимодействует с содержащимся в мышечной ткани белком миоглобином с образованием соединений кроваво-красного цвета. В больших количествах нитриты ядовиты. Смертельная для ребёнка доза нитрита натрия составляет всего 0,18 г.
Оксид азота(V) N2O5 — белое кристаллическое вещество, построенное из ионов NO+2 и NO3-. N2O5 — ангидрид азотной кислоты. Его крайне редко используют в лабораторной практике. Сама азотная кислота, напротив, незаменима в любой, самой скромной химической лаборатории.
Раствор азотистой кислоты HNO2. Азотистая кислота неустойчива, она разлагается на оксиды азота и воду: 2HNO2 =NO+NO2+Н2О. Выделяющийся NO окисляется кислородом воздуха до NO2.




Похожие статьи